Professional Documents
Culture Documents
سلسلة 1 باك 2022 -الأستاذ عابدي
سلسلة 1 باك 2022 -الأستاذ عابدي
Uploaded by
dido ahmedOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
سلسلة 1 باك 2022 -الأستاذ عابدي
سلسلة 1 باك 2022 -الأستاذ عابدي
Uploaded by
dido ahmedCopyright:
Available Formats
سلسلة التذكري للوحدة األوىل /بكالوريا * 2022األستاذ عابدي *
التطبيق األول
*1أكتب املعادلة النصفية لالرجاع للثنائيات التالية 𝟒 /𝑴𝒏 ) ; (𝑴𝒏𝑶𝟒 /𝑴𝒏𝑶) ; (𝑪𝒓𝟐 𝑶𝟕 /𝑪𝒓 ) :
(𝑴𝒏𝑶− 𝟐+ − 𝟐− 𝟑+
*2أكتب املعادلة النصفية لألكسدة للثنائيات التالية ∶ ) (𝑪𝑶𝟐 /𝑯𝟐 𝑪𝟐 𝑶𝟒 ) ; (𝑶𝟐 /𝑯𝟐 𝑶𝟐 ) ; (𝑰𝟐 /𝑰−
التطبيق الثاني :
*1ذكر بقوانني حساب كمية املادة املدروسة سابقا مع التحويالت املناسبة .
*2ذكر بقانون التمديد و كذا قانون حساب الرتكيز املولي حمللول جتاري .
*3ذكر بالربوتوكول التجرييب لتحضري حملول انطالقا من حملول جتاري .
التطبيق الثالث :
منزج يف اللحظة )𝟎 = 𝒕( حجما 𝑳𝒎𝟎𝟎𝟏 = 𝑽 من حملول حلمض كلور املاء )𝒒𝒂() (𝑯𝟑 𝑶+ + 𝑪𝒍−تركيزه املولي𝑳 𝑪 = 𝟏𝟎−𝟐 𝒎𝒐𝒍/مع
كتلة 𝒈𝟓𝟔 𝒎 = 𝟎,من الزنك )𝒔(𝒏𝒁 .
*1أحسب كمية املادة االبتدائية لكل متفاعل .
*2أكتب معادلة التفاعل احلادث ,يعطى ∶ )𝒏𝒁(𝑯𝟑 𝑶+ /𝑯𝟐 ); (𝒁𝒏𝟐+ /
*3أنشئ جدوال لتقدم التفاعل .
*4أحسب قيمة التقدم األعظمي 𝒙𝒂𝒎𝒙 ثم حدد املتفاعل احملد .
*5أوجد الرتكيب املولي للمزيج يف نهاية التفاعل .
*6استنتج حجم غاز ثنائي اهليدروجني 𝟐𝑯𝑽 املنطلق يف نهاية التفاعل .
املعطيات 𝑴(𝒁𝒏) = 𝟔𝟓, 𝟒 𝒈/𝒎𝒐𝑳 ; 𝑽𝑴 = 𝟐𝟒 𝑳/𝒎𝒐𝑳 :
التطبيق الرابع :
(𝑲+ + 𝑴𝒏𝑶−تركيزه املولي 𝑳 𝑪𝟏 = 𝟐. 𝟏𝟎−𝟐 𝒎𝒐𝒍/مع
حنضر مزجيا وذلك بإضافة حجم 𝑳𝒎𝟎𝟓 = 𝟏𝑽 من حملول برمنغنات البوتاسيوم ) 𝟒
حجم 𝑳𝒎𝟎𝟓 = 𝟐𝑽 من حملول األكسليك 𝟒𝑶 𝟐𝑪 𝟐𝑯 تركيزه املولي 𝑳𝑪𝟐 = 𝟏. 𝟏𝟎−𝟐 𝒎𝒐𝒍/
*1أحسب كمية املادة االبتدائية للمتفاعالت .
*2أكتب معادلة التفاعل احلادث .تعطى الثنائيات ) 𝟒𝑶 𝟐𝑪 𝟐𝑯𝟒 /𝑴𝒏 ); (𝑪𝑶𝟐 /
(𝑴𝒏𝑶− 𝟐+
*3أنشئ جدوال لتقدم التفاعل احلادث ,ثم حدد املتفاعل احملد.
[𝑴𝒏𝑶−و ] 𝟒𝑶 𝟐𝑪 𝟐𝑯[ يف املزيج يف اللحظة 𝟎 = 𝒕
*4أحسب كل من ] 𝟒
*5أوجد الرتكيب املولي للمزيج يف نهاية التفاعل .
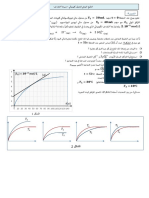
*6مثل كيفيا بيان كمية املادة للمتفاعالت والنواتج خالل التفاعل مرة بداللة الزمن ومرة بداللة تقدم التفاعل .
الصفحة 01 األستاذ عابدي عبداحلفيظ للعلوم الفيزيائية 2021/08/28
You might also like
- Bbl14bS MohamedDocument9 pagesBbl14bS MohamedrachidNo ratings yet
- الوحدة 01 سلسلة 01 السنة ثالثةDocument2 pagesالوحدة 01 سلسلة 01 السنة ثالثةÊš PőîřNo ratings yet
- سلسلة تمارين1 في الأكسدة ارجاع وتقدم التفاعل بكالورياDocument1 pageسلسلة تمارين1 في الأكسدة ارجاع وتقدم التفاعل بكالورياKhalid100% (1)
- 4 5879874055732990293Document5 pages4 5879874055732990293Loup le DésertNo ratings yet
- التتبع الزمني لتحول كيميائي -سرعة التفاعلDocument4 pagesالتتبع الزمني لتحول كيميائي -سرعة التفاعلAbidine CHAHIRNo ratings yet
- اختبار يحتوي تمرين معايرة س2Document2 pagesاختبار يحتوي تمرين معايرة س2mouad drouicheNo ratings yet
- Bb13B AflouDocument4 pagesBb13B AflouProfchaari SciencesNo ratings yet
- فيزياء - الوحدة 01 تحت المجهر النظري - نافع - بكالوريا 2023Document36 pagesفيزياء - الوحدة 01 تحت المجهر النظري - نافع - بكالوريا 2023feriel taibiNo ratings yet
- 1 Compo1 Litim Trim1Document3 pages1 Compo1 Litim Trim1Mariam ZouhairNo ratings yet
- سلسلة تمارين 1Document5 pagesسلسلة تمارين 1lisaNo ratings yet
- Dev113Ter RachidDocument3 pagesDev113Ter RachidSawssen BáràNo ratings yet
- 1593253161Document26 pages1593253161ashrafhaseas2006No ratings yet
- سلسلة التمارين رقم 1 الدورة الأولىDocument3 pagesسلسلة التمارين رقم 1 الدورة الأولىadnanNo ratings yet
- ملخص الوحدة 4 الناقلية 2022 2023Document3 pagesملخص الوحدة 4 الناقلية 2022 2023badrNo ratings yet
- سلسلة تمارين 1 علميDocument2 pagesسلسلة تمارين 1 علميAndyTeck Pro (Android)No ratings yet
- - المتابعة الزمنية امين 1Document8 pages- المتابعة الزمنية امين 1Saoussen Aissaoui100% (1)
- الاختبار الاول ثانوية بونور 2021-2022Document1 pageالاختبار الاول ثانوية بونور 2021-2022Daya Lebaili100% (1)
- 03 Sujets de Concours D'accès Au Doctorat en Physique Energétique - Ouargla 2021Document11 pages03 Sujets de Concours D'accès Au Doctorat en Physique Energétique - Ouargla 2021Ahmed BelguenouneNo ratings yet
- التمرين الاول 2021Document1 pageالتمرين الاول 2021Dh SilaNo ratings yet
- Dzexams Docs 3as 907400Document3 pagesDzexams Docs 3as 907400اسلام معزوزNo ratings yet
- الاختبار بالحلgDocument13 pagesالاختبار بالحلgاستاذك في الفيزياء100% (1)
- بيولوجياDocument23 pagesبيولوجياBoudaoud MensifNo ratings yet
- Dzexams 3as Physique 356279Document4 pagesDzexams 3as Physique 356279Yasser R99No ratings yet
- سلسلة تمارين بالحل المفصل في وحدة الأسترةDocument13 pagesسلسلة تمارين بالحل المفصل في وحدة الأسترةSalim Salim83% (6)
- سلسلة المكتسبات القبلية 2023 (جبالي رفيق)Document3 pagesسلسلة المكتسبات القبلية 2023 (جبالي رفيق)Hina BouzerzourNo ratings yet
- Physics 3mtm 3trim14Document9 pagesPhysics 3mtm 3trim14ebouretalNo ratings yet
- - - - - الحلقة (8) تمرين حول المتابعة الزمنية عن طريق المعايرة اللونيةDocument6 pages- - - - الحلقة (8) تمرين حول المتابعة الزمنية عن طريق المعايرة اللونيةAbdou0% (2)
- UntitledDocument3 pagesUntitledAmina ElgharbiNo ratings yet
- BAC23 Doc1Document2 pagesBAC23 Doc1Sekkoum AhmedNo ratings yet
- Ahmad OusoussDocument6 pagesAhmad Ousoussryad aouidatNo ratings yet
- امتحان تجريبي في الفيزياء مع التصحيح PDFDocument10 pagesامتحان تجريبي في الفيزياء مع التصحيح PDFzakkou100% (6)
- BAC2023 Doc1Document2 pagesBAC2023 Doc1Hina BouzerzourNo ratings yet
- BAC2023 Doc1Document2 pagesBAC2023 Doc1Soumia KerdNo ratings yet
- الاختبارات النفسية PDFDocument34 pagesالاختبارات النفسية PDFمحمدأبوساجدةNo ratings yet
- الواجب المنزلي 03Document2 pagesالواجب المنزلي 03karim KhaledNo ratings yet
- سلسلة تمارين متعلقة بالمكتسبات القبليةDocument2 pagesسلسلة تمارين متعلقة بالمكتسبات القبليةBOUCHEFFA HalimNo ratings yet
- كيمياء التفاعلات الكيميائيةDocument29 pagesكيمياء التفاعلات الكيميائيةBe YaraNo ratings yet
- Série 2 2AC Prof - Azizi (WWW - Pc1.ma)Document1 pageSérie 2 2AC Prof - Azizi (WWW - Pc1.ma)adnanNo ratings yet
- سلسلة تمارين المكتسبات القبلية 2022Document7 pagesسلسلة تمارين المكتسبات القبلية 2022Miss MNo ratings yet
- Ficher 23Document3 pagesFicher 23DEBLOFNo ratings yet
- !!Document4 pages!!bouthinaaanrNo ratings yet
- 32alfiziaa Oalkimiaa Alom Fiziaiia 2015 Aldora Alistdrakia Altshih 1Document7 pages32alfiziaa Oalkimiaa Alom Fiziaiia 2015 Aldora Alistdrakia Altshih 1Youssef YoussefNo ratings yet
- الوحدة 01 سلسلة المتابعة الزمنية عن طريق قياس الحجمDocument2 pagesالوحدة 01 سلسلة المتابعة الزمنية عن طريق قياس الحجمZizo Dark100% (2)
- الدرس 01Document4 pagesالدرس 01Khaled MansouriNo ratings yet
- الدرس 01Document4 pagesالدرس 01Moussa BeghilNo ratings yet
- (الفرض الأول (3ر+تقرDocument2 pages(الفرض الأول (3ر+تقرNasser Eddine AbdouNo ratings yet
- سلسلة الوحدة 1 المتابعة الزمنيةDocument8 pagesسلسلة الوحدة 1 المتابعة الزمنيةMohamed Anis LounisNo ratings yet
- الوحدة 01 سلسلة تمارين حصص zoomDocument4 pagesالوحدة 01 سلسلة تمارين حصص zoomferiel taibiNo ratings yet
- Suivi TemporelDocument3 pagesSuivi Temporelmourafiq faysal100% (1)
- اختبار للفصل الثاني سنة ثانية تقني الحل رياضيDocument6 pagesاختبار للفصل الثاني سنة ثانية تقني الحل رياضيdfdfdfNo ratings yet
- اقتصاد س1Document2 pagesاقتصاد س1Hadjer ZntNo ratings yet
- Serie 1Document1 pageSerie 1abidoo lekmitiNo ratings yet
- الدّرس 02 تذكير بمكتسبات السّنة 01 و 02 ثانويDocument9 pagesالدّرس 02 تذكير بمكتسبات السّنة 01 و 02 ثانويtaiebbrahimislamNo ratings yet
- Dzexams 2as Physique 1978355Document7 pagesDzexams 2as Physique 1978355bourrega fatahNo ratings yet
- فرض محروس رقم 1 الدورة الأولى نموذج 1Document2 pagesفرض محروس رقم 1 الدورة الأولى نموذج 1Jamal ChahiriNo ratings yet
- Compo215MTer ArbaouiDocument4 pagesCompo215MTer ArbaouiNabilKarmNo ratings yet
- _Document25 pages_Mouhand MhendNo ratings yet
- العلاقة بين الأفراد الكيميائيةDocument3 pagesالعلاقة بين الأفراد الكيميائيةlynamellah415No ratings yet
- Sujet 01-1Document4 pagesSujet 01-1ahmed bacaloriaNo ratings yet