Professional Documents
Culture Documents
Kemija
Uploaded by
icogicaCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Kemija
Uploaded by
icogicaCopyright:
Available Formats
Kemija Ravnotežne reakcije
Dinamično ravnotežje
Topnost
Produkti se pretvarjajo nazaj v reaktante = reverzibilna ali obojesmerna
Največja količina topljenca, ki ga lahko raztopimo v neki količini topila
reakcija
pri določeni temperaturi. Običajno jo navajamo kot maso raztopljenega
topljenca v 100g topila (običajno vode) pri določeni temperaturi. Topnost Del reaktantov pretvori v produkte, del reaktantov pa ne zreagira →
je odvisna od vrste topljenca, vrste topila in temperature. med reaktanti in produkti se vzpostavi ravnotežje
Nasičena raztopina je raztopina, ki vsebuje največjo možno količino Omejili se bomo na ravnotežja med snovmi v plinastem agregatnem
raztopljenega topljenca pri določeni temperaturi. stanju = homogena ravnotežja.
Večina trdnih topljencev ima večjo topnost pri višji temperaturi. Dinamično ravnotežje je stanje ravnotežnega sistema, v katerem sta
hitrost fizikalnih ali kemijskih sprememb v nasprotnih smereh enaki.
S krivuljo topnosti predstavljamo topnost pri različnih temperaturah.
V ravnotežju je hitrost reakcije v desno enaka hitrosti reakcije v levo.
Zapis konstante ravnotežja
Razmerje med ravnotežnimi koncentracijami produktov in reaktantov
določene kemijske reakcije je pri določeni temperaturi konstantno.
Konstanta ravnotežja Kc je matematični izraz, ki opisuje razmerje med
ravnotežnimi koncentracijami produktov in reaktantov pri določeni
Hitrost raztapljanja ≠ topnost (hitrost raztapljanja povečamo z mešanjem temperaturi.
in uporabo bolj drobnega topljenca)
Oglati oklepaji simbolizirajo množinsko koncentracijo.
Vrednost konstante ravnotežja Pretvarjanje konstant ravnotežja
Iz Kc lahko sklepamo, ali je v ravnotežju več reaktantov ali produktov. Konstanta ravnotežja Kc je vezana na zapisano enačbo kemijske reakcije.
Vrednost konstante ravnotežja je smiselno navajati le ob napisani
Zelo majhna vrednost konstante ravnotežja pomeni, da v ravnotežju
enačbi kemijske reakcije.
prevladujejo reaktanti oz. se je le majhen delež reaktantov pretvoril v
produkte. (ravnotežje pomaknjeno v smer reaktantov)
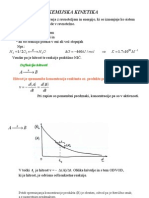
Izračun konstante ravnotežja
Izračun iz ravnotežnih koncentracij
Zelo velika vrednost konstante ravnotežja (Kc >> 1) pomeni, da v
ravnotežju prevladujejo produkti oz. se je večji delež reaktantov
pretvoril v produkte. (ravnotežje pomaknjeno v smer produktov)
Odvisna od temperature!
Ni odvisna od količine snovi v ravnotežju.
Vplivi na kemijsko ravnotežje Potek kemijskih reakcij
La Chatelierovo načelo Ravnotežja v vodnih raztopinah
Če se v sistemu, ki je v ravnotežju, spremeni temperatura, tlak ali
koncentracija reaktantov oz. produktov, se položaj ravnotežja spremeni v Imenovanje kislin, baz in soli
smer, ki minimalizira to spremembo. Pregled najpomembnejših kislin in njihovih soli
Povečanje tlaka: ravnotežje premakne v smer manjšega števila delcev kemijska ime kisline po anion ime soli
plinastih snovi formula Stockovem sistemu (brez končnice –ni in
Zmanjšanje tlaka: v smer večjega števila delcev plinastih snovi (z oksidacijskim besede »ion«)
številom)
HCl klorovodikova kislina Cl- klorid
HBr bromovodikova kislina Br- bromid
HF fluorovodikova kislina F- fluorid
Zvišanje temperature: v smer endotermne reakcije HI jodovodikova kislina I- jodid
Znižanje temperature: v smer eksotermne reakcije HNO3 dušikova(V) kislina NO3- nitrat(V)
HNO2 dušikova(III) kislina NO2- nitrat(III)
HCN cianovodikova kislina CN- cianid
H2SO4 žveplova(VI) kislina HSO4- hidrogensulfat(VI)
SO42- sulfat(VI)
Povečanje koncentracije reaktantov/zmanjšanje koncentracije
produktov: v smer nastanka produktov H2SO3 žveplova(IV) kislina HSO3- hidrogensulfat(IV)
SO32- sulfat(IV)
Zmanjšanje koncentracije reaktantov/povečanje koncentracije
produktov: v smer nastanka reaktantov H2CO3 (ogljikova(IV) kislina) HCO3- hidrogenkarbonat
ogljikova kislina CO32- karbonat
H2S žveplovodikova kislina HS- hidrogensulfid
S2- sulfid
Katalizator ne vpliva na položaj kemijskega ravnotežja.
H3PO4 fosforjeva(V) kislina H2PO4- dihidrogenfosfat(V)
HPO42- hidrogenfosfat(V)
PO43- fosfat(V)
H3PO3 fosforjeva(III) kislina H2PO3- dihidrogenfosfat(III)
HPO32- hidrogenfosfat(III)
HClO klorova(I) kislina ClO- klorat(I)
HClO2 klorova(III) kislina ClO2- klorat(III)
HClO3 klorova(V) kislina ClO3- klorat(V)
HClO4 klorova(VII) kislina ClO4- klorat(VII)
-
HCOOH mravljinčna ali HCOO format (metanoat)
metanojska kislina
CH3COOH ocetna ali etanojska CH3COO- acetat (etanoat)
kislina
Najpomembnejša sprejemljiva običajna imena
H2SO4 žveplova kislina
H3PO4 fosforjeva kislina
HNO3 dušikova kislina
Protolitske reakcije
You might also like
- Hemiski ReakciiDocument10 pagesHemiski ReakciistefannnnNo ratings yet
- ACIDOBAZNADocument32 pagesACIDOBAZNADani StojanovaNo ratings yet
- Enzimi Ii CasDocument35 pagesEnzimi Ii CasLG GLNo ratings yet
- Skripta FT2Document39 pagesSkripta FT2api-3814389100% (3)
- Stabilnost ZdravilDocument9 pagesStabilnost ZdravilŠpela StrgarNo ratings yet
- 10.1 Motnje V Acido-Baznem Ravnotežju-Za StudenteDocument32 pages10.1 Motnje V Acido-Baznem Ravnotežju-Za StudenteNejraNo ratings yet
- KinetikaDocument31 pagesKinetikaJasna MaksimovaNo ratings yet
- Prev Znanja KemDocument1 pagePrev Znanja Kemblaz.pergerNo ratings yet
- Homeostaza Na Vodorod I Acidobazna Ramnoteza2010Document12 pagesHomeostaza Na Vodorod I Acidobazna Ramnoteza2010Dani StojanovaNo ratings yet
- AlkaniDocument50 pagesAlkaniAna BrokiNo ratings yet
- Pomosen Materijal-Redoks ReakciiDocument38 pagesPomosen Materijal-Redoks ReakciiMage MageNo ratings yet
- Seminar: PuferiDocument42 pagesSeminar: PuferiMilamarinaNo ratings yet
- Biokemija 2Document20 pagesBiokemija 2Alen Ksoll100% (1)
- Prirodni NaukiDocument14 pagesPrirodni NaukiElena Andonovska CvetkovskaNo ratings yet
- Obarjalne Titracije4Document9 pagesObarjalne Titracije4Dejan DjokićNo ratings yet
- Farmacevti-TitracijeDocument12 pagesFarmacevti-TitracijeNika PahorNo ratings yet
- Šalabahter KemijaDocument2 pagesŠalabahter KemijaLuka Šimić100% (1)
- 1-Teorii Za Kiselini I BaziDocument39 pages1-Teorii Za Kiselini I BaziTodorka JanevskaNo ratings yet
- FK3QSAR09Document38 pagesFK3QSAR09api-3814389No ratings yet
- Pomen Variiranja SubstituentovDocument26 pagesPomen Variiranja Substituentovapi-3814389No ratings yet
- Koordinacijske SpojineDocument3 pagesKoordinacijske SpojineLeticija AmbrozicNo ratings yet
- Seminar-Voda Ind. FarmacijaDocument42 pagesSeminar-Voda Ind. FarmacijaMaruša AravsNo ratings yet
- Organska KemijaDocument31 pagesOrganska Kemijarenegton94No ratings yet
- KinetikaDocument12 pagesKinetikaNataša BevkNo ratings yet
- 10.1 Motnje V Acido-Baznem Ravnotežju-Za studente-SVDocument32 pages10.1 Motnje V Acido-Baznem Ravnotežju-Za studente-SVNejraNo ratings yet
- 2L 1 Entalpija Kemijske Reakcije VernierDocument2 pages2L 1 Entalpija Kemijske Reakcije VernierJan SimičNo ratings yet
- 1-Teorii Za Kiselini I BaziDocument39 pages1-Teorii Za Kiselini I BaziDusko MatejicNo ratings yet
- 1. СПЕЦИФИЧНИ ФИЗИЧКО-ХЕМИСКИ ОСОБИНИDocument36 pages1. СПЕЦИФИЧНИ ФИЗИЧКО-ХЕМИСКИ ОСОБИНИAlen VukosavljevicNo ratings yet
- Celotna Destilacija Z VodnoparoDocument18 pagesCelotna Destilacija Z VodnoparoSimon ErjavecNo ratings yet
- Navodila Za Izvedbo Vaje Acidoalkalimetrija 2011Document10 pagesNavodila Za Izvedbo Vaje Acidoalkalimetrija 2011Nika JapeljNo ratings yet
- Poglavlje 9 (Reakcije Alkohola)Document49 pagesPoglavlje 9 (Reakcije Alkohola)Др ЗокиNo ratings yet
- Kiseline I BazeDocument4 pagesKiseline I BazeBiljana Penjin50% (2)
- Odgovori Na FK1Document21 pagesOdgovori Na FK1Neža MikeljNo ratings yet
- Okfh2 05 PDFDocument79 pagesOkfh2 05 PDFGlas mlisNo ratings yet
- Aminokiseline I Proteini Za 5Document56 pagesAminokiseline I Proteini Za 5Pavle DujkicNo ratings yet
- Skripta 2. LetnikDocument43 pagesSkripta 2. LetnikIvan GrceNo ratings yet
- 14 AK Kisline Baze Nevodna TopilaDocument32 pages14 AK Kisline Baze Nevodna TopilaMarija KovačevićNo ratings yet
- Nastavna Programa IIDocument14 pagesNastavna Programa IIShaip DautiNo ratings yet
- Izpit Analizne Kemije LBM 2020Document2 pagesIzpit Analizne Kemije LBM 2020Lucija VogaNo ratings yet
- Klasifikacija Neorganskih Jedinjenja 1Document54 pagesKlasifikacija Neorganskih Jedinjenja 1Maja DjordjevicNo ratings yet
- Bazalna Presnova in Napor 2007Document24 pagesBazalna Presnova in Napor 2007api-3814389No ratings yet
- Vprašanja Z Odgovori, KemijaDocument7 pagesVprašanja Z Odgovori, KemijaMonikaGrajNo ratings yet
- Izpit PrimerDocument2 pagesIzpit Primerxander12341234No ratings yet
- Formiranje I Nastajanje NOxDocument3 pagesFormiranje I Nastajanje NOxIv_anaNo ratings yet
- 7 AK Mehanizmi Prvi DelDocument55 pages7 AK Mehanizmi Prvi DelMarija KovačevićNo ratings yet
- 01-09 - Samostalni ZadaciDocument17 pages01-09 - Samostalni ZadacijjzoranNo ratings yet
- Organska Kemija 2 - Slovenacki JezikDocument181 pagesOrganska Kemija 2 - Slovenacki JezikDejan MiticNo ratings yet
- FK3 Cefalosporini 1011Document24 pagesFK3 Cefalosporini 1011Marko AnderluhNo ratings yet
- Bahan Diskusi Stoikiometri Pekan Ke-4Document17 pagesBahan Diskusi Stoikiometri Pekan Ke-4Nur AnnisahNo ratings yet
- Klasifikacija Neorganskih Jedinjenja 1Document54 pagesKlasifikacija Neorganskih Jedinjenja 1Maja DjordjevicNo ratings yet
- 7 Chapter-1Document21 pages7 Chapter-1saramarkovikj47No ratings yet
- 4 Termodinamika Vlaznega ZrakaDocument31 pages4 Termodinamika Vlaznega ZrakaMelissa WilliamsNo ratings yet
- Bioorg 2022 23Document195 pagesBioorg 2022 23Gašper MožinaNo ratings yet
- KEMIJA - VODIK, Skripta, 4. Razred GimnazijeDocument9 pagesKEMIJA - VODIK, Skripta, 4. Razred GimnazijePaolaNo ratings yet
- 7 Chapter PDFDocument21 pages7 Chapter PDFIvicaNo ratings yet
- VodikDocument18 pagesVodikZoran SamanicNo ratings yet