Professional Documents
Culture Documents
4 - Jadual Berkala Unsur PDF
4 - Jadual Berkala Unsur PDF
Uploaded by
Wan ShuhaimiOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
4 - Jadual Berkala Unsur PDF
4 - Jadual Berkala Unsur PDF
Uploaded by
Wan ShuhaimiCopyright:
Available Formats
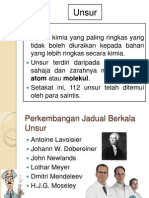
JADUAL BERKALA UNSUR
1 Blog: cikgu-lan.blogspot.com Facebook: azlanbudun
Antoine Lavoiser (1743 1794) merupakan ahli sains yang
telah mengelaskan bahan-bahan kepada logam dan bukan
logam.
Walau bagaimanapun, pengelasannya tidak berjaya kerana
cahaya, haba dan beberapa sebatian yang lain turut dianggap
sebagai unsur.
Pada tahun 1829, Johann Dobereiner telah membahagikan
unsur-unsur kepada kumpulan.
Setiap kumpulan mengandungi tiga unsur dengan sifat kimia
yang serupa yang dikenali sebagai triad Dobereiner.
2 Blog: cikgu-lan.blogspot.com Facebook: azlanbudun
Pada tahun 1864, John Newlands telah menyusun unsur
mengikut tertib menaik jisim atom. Beliau telah
mengenalkan Hukum Oktaf iaitu sifat yang serupa berulang
pada setiap unsur kelapan dalam susunannya.
Malangnya Hukum Oktaf gagal kerana hanya dipatuhi oleh 17
unsur yang pertama.
Pada tahun 1870, Lothar Meyer telah memplot graf isi padu
atom melawan jisim atom bagi semua unsur yang wujud
ketika itu.
3 Blog: cikgu-lan.blogspot.com Facebook: azlanbudun
Beliau berjaya menunjukkan bahawa sifat unsur dapat
membentuk suatu corak berkala terhadap jisim atomnya.
Pada tahun 1869, Dmitri Mendeleev menyusun unsur
mengikut tertib menaik jisim atom dan mengelaskannya
mengikut sifat kimia yang serupa.
Beliau meninggalkan ruang kosong dalam jadualnya bagi
unsur-unsur yang belum ditemui dan mampu meramalkan
sifat-sifat unsur ini.
Pada tahun 1914, Henry J. G. Moseley telah membuat kajian
spektrum sinar-X bagi unsur.
4 Blog: cikgu-lan.blogspot.com Facebook: azlanbudun
Beliau telah menyusun semula unsur mengikut tertib menaik
nombor proton dalam Jadual Berkala Unsur dan sekali gus
mengesahkan penemuan Mendeleev.
5 Blog: cikgu-lan.blogspot.com Facebook: azlanbudun
Jadual Berkala Unsur moden ialah satu kaedah menyusun
unsur-unsur mengikut tertib menaik nombor proton.
Struktur asas Jadual Berkala Unsur ialah pembahagian
kepada lajur menegak dan baris mendatar.
Lajur menegak dipanggil Kumpulan dan dinombor dengan 1
hingga 18.
Nombor kumpulan bagi sesuatu unsur bergantung pada
bilangan elektron valens atom unsur tersebut.
Baris mendatar dipanggil Kala dan di nombor dengan 1
hingga 7.
6 Blog: cikgu-lan.blogspot.com Facebook: azlanbudun
Nombor kala bagi sesuatu unsur bergantung pada bilangan petala
berisi elektron atom unsur tersebut.
Logam terletak di sebelah kiri manakala bukan logam terletak
disebelah kanan Jadual Berkala Unsur.
Saiz atom dan sifat kelogaman unsur-unsur semakin bertambah
semasa menuruni kumpulan.
Saiz atom dan sifat kelogaman unsur-unsur semakin berkurang
semasa merentas kala dari kiri ke kanan.
Keelektropositifan unsur bertambah semasa menuruni
kumpulan.
Keelektronegatifan unsur bertambah semasa merentas kala dari
kiri ke kanan.
7 Blog: cikgu-lan.blogspot.com Facebook: azlanbudun
8 Blog: cikgu-lan.blogspot.com Facebook: azlanbudun
Unsur unsur Kumpulan 18 terdiri daripada helium, neon, argon,
kripton, xenon dan radon. Unsur-unsur ini dinamakan gas adi.
Gas adi mempunyai saiz atom yang kecil, tidak berwarna pada suhu dan
tekanan bilik serta mempunyai takat lebur, takat didih dan ketumpatan
yang rendah.
Petala terluar setiap unsur Kumpulan 18 diisi penuh dengan elektron.
Atom helium, He mempunyai dua elektron valens iaitu susunan elektron
duplet.
Gas-gas adi yang lain mempunyai lapan elektron valens iaitu susunan
elektron oktet.
Susunan-susunan elektron ini sangat stabil dan menjadikan gas-gas adi
tidak reaktif atau lengai secara kimia.
Gas-gas adi tidak perlu menerima, melepaskan atau berkongsi elektron
dengan unsur-unsur lain.
9 Blog: cikgu-lan.blogspot.com Facebook: azlanbudun
Unsur-unsur Kumpulan 1 terdiri daripada litium, natrium,
kalium, rubidium, sesium dan fransium.
Unsur-unsur ini dikenali logam alkali.
Unsur kumpulan 1 adalah lembut, konduktor haba dan
elektrik yang baik, berwarna kelabu dan berkilau bagi
permukaan yang baharu dipotong, serta mempunyai takat
lebur, takat didih dan ketumpatan yang rendah.
10 Blog: cikgu-lan.blogspot.com Facebook: azlanbudun
Semasa menuruni Kumpulan 1:
Saiz atom semakin bertambah kerana petala berisi elektron
semakin bertambah
Kereaktifan bertambah
Takat lebur dan takat didih berkurang
Ketumpatan meningkat
11 Blog: cikgu-lan.blogspot.com Facebook: azlanbudun
Setiap atom logam unsur Kumpulan 1 mempunyai satu
elektron valens.
Semasa tindak balas kimia, elektron valens akan dilepaskan
untuk mencapai susunan elektron oktet yang stabil dan
membentuk ion bercas +1.
12 Blog: cikgu-lan.blogspot.com Facebook: azlanbudun
Logam alkali bertindak balas dengan air secara cergas
menghasilkan larutan hidroksida logam yang beralkali dan gas
hidrogen, H2.
Contoh:
2Li(p) + 2H2O(ce) 2LiOH(ak) + H2(g)
2Na(p) + 2H2O(ce) 2NaOH(ak) + H2(g)
2K(p) + 2H2O(ce) 2KOH(ak) + H2(g)
13 Blog: cikgu-lan.blogspot.com Facebook: azlanbudun
Logam alkali terbakar dalam gas oksigen, O2 menghasilkan
pepejal putih oksida logam.
Contoh:
4Li(p) + O2(g) 2Li2O(p)
4Na(p) + O2(g) 2Na2O(p)
4K(p) + O2(g) 2K2O(p)
14 Blog: cikgu-lan.blogspot.com Facebook: azlanbudun
Pepejal oksida logam yang terhasil larut di dalam air untuk
membentuk larutan hidroksida logam yang beralkali.
Larutan ini mengubah warna penunjuk fenolftalein daripada
merah jambu kepada tak berwarna.
Contoh:
Li2O(p) + H2O(ce) 2LiOH(ak)
Na2O(p) + H2O(ce) 2NaOH(ak)
K2O(p) + H2O(ce) 2KOH(ak)
15 Blog: cikgu-lan.blogspot.com Facebook: azlanbudun
Logam alkali terbakar dalam gas klorin, Cl2 untuk
membentuk pepejal putih klorida logam.
Contoh:
2Li(p) + Cl2(g) 2LiCl(p)
2Na(p) + Cl2(g) 2NaCl(p)
2K(p) + Cl2(g) 2KCl(p)
16 Blog: cikgu-lan.blogspot.com Facebook: azlanbudun
Unsur-unsur Kumpulan 17 (halogen) terdiri daripada:
Fluorin
Klorin
Bromin
Iodin
Astatin
17 Blog: cikgu-lan.blogspot.com Facebook: azlanbudun
Apabila menuruni Kumpulan 17:
Saiz atom semakin bertambah kerana petala berisi elektron
semakin bertambah
Kereaktifan berkurang
Takat lebur dan takat didih meningkat
Ketumpatan meningkat
Warna semakin gelap
18 Blog: cikgu-lan.blogspot.com Facebook: azlanbudun
Setiap atom halogen mempunyai tujuh elektron valens.
Semasa tindak balas kimia, atom halogen akan menerima satu
elektron untuk mencapai susunan elektron oktet yang stabil
dan membentuk ion bercas -1.
19 Blog: cikgu-lan.blogspot.com Facebook: azlanbudun
Halogen bertindak balas dengan air untuk membentuk dua
jenis asid.
Contoh:
Cl2(ak) + H2O(ce) HOCl(ak) + HCl(ak)
Br2(ak) + H2O(ce) HOBr(ak) + HBr(ak)
I2(ak) + H2O(ce) HOI(ak) + HI(ak)
20 Blog: cikgu-lan.blogspot.com Facebook: azlanbudun
Halogen bertindak balas dengan larutan natrium hidroksida,
NaOH membentuk natrium halida, natrium halat(I) dan air.
Contoh:
Br2(p) + 2NaOH(ak) NaBr(ak) + NaOBr(ak) + H2O(ce)
I2(p) + 2NaOH(ak) NaI(ak) + NaOI(ak) + H2O(ce)
21 Blog: cikgu-lan.blogspot.com Facebook: azlanbudun
Halogen dalam keadaan gas bertindak balas dengan ferum
yang panas untuk membentuk ferum (III) halida.
Contoh:
3Cl2(g) + 2Fe(p) 2FeCl3(p)
3Br2(g) + 2Fe(p) 2FeBr3(p)
3I2(p) + 2Fe(p) 2FeI3(p)
22 Blog: cikgu-lan.blogspot.com Facebook: azlanbudun
Merentas Kala 3 pada Jadual Berkala Unsur dari kiri ke
kanan:
Nombor proton bertambah daripada satu unsur ke unsur yang
berikutnya
Semua atom unsur mempunyai 3 petala yang berisi elektron
Bilangan elektron valens bertambah dari 1 hingga 8
Semua unsur wujud sebagai pepejal kecuali klorin dan argon
yang merupakan gas
Jejari dan saiz atom unsur semakin berkurang
Keelektronegatifan unsur semakin bertambah disebabkan daya
tarikan nukleus terhadap elektron valens bertambah kuat
23 Blog: cikgu-lan.blogspot.com Facebook: azlanbudun
Semasa merentas Kala 3 dari kiri ke kanan:
Unsur-unsur berubah daripada pepejal kepada gas
{Na, Mg, Al, Si, P, S,} {Cl, Ar}
Pepejal Gas
Unsur-unsur berubah daripada logam kepada separuh logam
(metaloid) dan kemudian bukan logam.
{Na, Mg, Al,} {Si,} {P, S, Cl, Ar}
Logam Separuh logam Bukan logam
Oksida bagi unsur-unsur berubah daripada bes kepada
amfoterik dan kemudian asid.
{Na2O, MgO,} {Al2O3,} {SiO2, P4O10, SO2, Cl2O7}
Oksida bes Amfoterik Oksida asid
24 Blog: cikgu-lan.blogspot.com Facebook: azlanbudun
Unsur-unsur peralihan berada dalam Kumpulan 3 hingga
Kumpulan 12 pada Jadual Berkala Unsur.
Contoh unsur peralihan ialah:
Titanium
Tungsten
Ferum
Nikel
Kuprum
Kromium
25 Blog: cikgu-lan.blogspot.com Facebook: azlanbudun
logam
pepejal
konduktor
haba dan permukaan
elektrik berkilat
yang baik
SEMUA
UNSUR
mempunyai PERALIHAN
takat lebur
mulur
dan takat
didih tinggi
mempunyai
kekuatan boleh
regangan ditempa
tinggi
26 Blog: cikgu-lan.blogspot.com Facebook: azlanbudun
Membentuk ion
atau sebatian yang
berwarna
SIFAT
ISTIMEWA
UNSUR
PERALIHAN
Menunjukkan
Bertindak sebagai
pelbagai nombor
mangkin dalam
pengoksidaan
tindak balas kimia
dalam sebatiannya
27 Blog: cikgu-lan.blogspot.com Facebook: azlanbudun
You might also like
- Kertas 1 Kimia Tingkatan 4 DwibahasaDocument13 pagesKertas 1 Kimia Tingkatan 4 Dwibahasaafida0511100% (1)
- BAB 4 - Jadual Berkala UnsurDocument64 pagesBAB 4 - Jadual Berkala UnsurNini Asnini Ismail0% (1)
- Bab 4 Jadual Berkala UnsurDocument40 pagesBab 4 Jadual Berkala Unsurtheebighaa100% (2)
- Nota Kimia Tingkatan 4 (BAB 4)Document92 pagesNota Kimia Tingkatan 4 (BAB 4)Master KutttyNo ratings yet
- Jadual Berkala Unsur Edit PENTINGDocument54 pagesJadual Berkala Unsur Edit PENTINGMohd Zaid Bin Mamat IPGKSMNo ratings yet
- Jadual Berkala UnsurDocument20 pagesJadual Berkala UnsurMuhd Zul Hakim100% (1)
- Tugasan 1Document46 pagesTugasan 1nairaNo ratings yet
- Modul 3 PDP Bab Jadual Berkala Unsur KimiaDocument18 pagesModul 3 PDP Bab Jadual Berkala Unsur KimiaSallyza SaharomNo ratings yet
- Tindak Balas KimiaDocument9 pagesTindak Balas KimiaizzuddinkhalidNo ratings yet
- Jadual Berkala Unsur Bab4Document37 pagesJadual Berkala Unsur Bab4DygnrctsaimahNo ratings yet
- 5 6082466975890538672Document40 pages5 6082466975890538672Nurul Hidayah YahayaNo ratings yet
- Percobaan 11Document18 pagesPercobaan 11atik sofiahNo ratings yet
- Smkkuala Perlis - Ujian Diagnostik Kimia 2012Document31 pagesSmkkuala Perlis - Ujian Diagnostik Kimia 2012jzhsmkkpsNo ratings yet
- Soalan Kertas 1Document15 pagesSoalan Kertas 1张晨曦No ratings yet
- Bab 4 Jadual Berkala Unsur PDFDocument5 pagesBab 4 Jadual Berkala Unsur PDFZuhal WorldNo ratings yet
- Kimia Form 5 Paper 1Document14 pagesKimia Form 5 Paper 1Hairolhamzi Bin BahroddinNo ratings yet
- Tindak Balas RedoksDocument30 pagesTindak Balas RedoksleaderofmoonNo ratings yet
- Hitung Bil Mol Karbon Dioksida Yang Terbentuk Apabila 40Document4 pagesHitung Bil Mol Karbon Dioksida Yang Terbentuk Apabila 40vkttNo ratings yet
- Region Fix No KunciDocument24 pagesRegion Fix No KunciRiia OktaviaNo ratings yet
- KIMIA T4 KSSM BAB 4 Jadual Berkala Unsur Zila Khalid )Document92 pagesKIMIA T4 KSSM BAB 4 Jadual Berkala Unsur Zila Khalid )Shin ObiNo ratings yet
- Jadual Berkala Dan Ikatan KimiaDocument7 pagesJadual Berkala Dan Ikatan KimiaSujatha KalimuthuNo ratings yet
- 3561a-Bab-3-Pengoksidaan-Dan-Penurunan Damia ContDocument31 pages3561a-Bab-3-Pengoksidaan-Dan-Penurunan Damia Contforyourhonour wongNo ratings yet
- Nota Latihan Bab 4Document4 pagesNota Latihan Bab 4Sallyza SaharomNo ratings yet
- 3 - Formula Dan Persamaan KimiaDocument32 pages3 - Formula Dan Persamaan KimiaNorjanah RamliNo ratings yet
- Kertas Peperiksaan SPM 2006Document7 pagesKertas Peperiksaan SPM 2006ramzilahNo ratings yet
- Melaka Trial2016 Kertas 123 DGN JWPNDocument91 pagesMelaka Trial2016 Kertas 123 DGN JWPNThanabalan MunuswamyNo ratings yet
- Nota KimiaDocument32 pagesNota KimiaFudhail JamalullainNo ratings yet
- Antara Kepentingan Jadual Berkala Dalam Bidang Kimia Termasuklah Membantu Kta Dalam MembuatDocument17 pagesAntara Kepentingan Jadual Berkala Dalam Bidang Kimia Termasuklah Membantu Kta Dalam MembuatMUKUNo ratings yet
- Ujian Ulangkaji Kimia T5 2013Document11 pagesUjian Ulangkaji Kimia T5 2013Ida Syahida100% (1)
- C 4 Jadual BerkalaDocument20 pagesC 4 Jadual BerkalaHenerita RayNo ratings yet
- Reaksi OksidasiDocument52 pagesReaksi OksidasiSoPhia AllaminNo ratings yet
- Jawapan Bab 4Document3 pagesJawapan Bab 4Azrul Aziz63% (8)
- Ikatan KimiaDocument6 pagesIkatan Kimiafahril abdjanNo ratings yet
- Tov Kimia 2013Document11 pagesTov Kimia 2013Khairul HakiminNo ratings yet
- Soal PAS Kimia SMK SMSTR 1Document3 pagesSoal PAS Kimia SMK SMSTR 1Asri AyieqNo ratings yet
- UNIT 8 Jadual Berkala PDFDocument26 pagesUNIT 8 Jadual Berkala PDFMatYie75% (4)
- Pat Kimia Form 4 P1 2017Document12 pagesPat Kimia Form 4 P1 2017ejalzzNo ratings yet
- Kimia NuklearDocument13 pagesKimia NuklearMansor Abdul RahmanNo ratings yet
- Kimia SPMDocument57 pagesKimia SPMummu AhmadNo ratings yet
- PelajaranDocument6 pagesPelajaranDini AgustinaNo ratings yet
- (WWW - Banksoal.web - Id) Soal Ujian Semester II SMA Kelas X - KimiaDocument2 pages(WWW - Banksoal.web - Id) Soal Ujian Semester II SMA Kelas X - KimiaDhe-dhew Dewii KoeMalaNo ratings yet
- Persamaan Kimia KSSMDocument26 pagesPersamaan Kimia KSSMsitiNo ratings yet
- SPM Kim BS 1 1Document12 pagesSPM Kim BS 1 1api-3841296No ratings yet
- Nota Ringkas Kimia SPM - RedoksDocument12 pagesNota Ringkas Kimia SPM - RedoksKHA120099 StudentNo ratings yet
- 20130911130918UNIT 8 Jadual Berkala 2 PDFDocument19 pages20130911130918UNIT 8 Jadual Berkala 2 PDFJavier MckinneyNo ratings yet
- Laporan Tetap Kimanorg IDocument45 pagesLaporan Tetap Kimanorg IstobeeeeNo ratings yet
- Bab 4 Jadual Berkala Unsur - PPTX 2Document25 pagesBab 4 Jadual Berkala Unsur - PPTX 2Idzham RozemanNo ratings yet
- Contoh Soal Bahan KorosiDocument19 pagesContoh Soal Bahan KorosiWida AdeliaNo ratings yet
- Soalan & Skema Kimia k1Document14 pagesSoalan & Skema Kimia k1ROSNA MALMODNo ratings yet
- BAB 3 - Formula & Persamaan KimiaDocument69 pagesBAB 3 - Formula & Persamaan KimiaShamshul DidarellyNo ratings yet
- Cf86ed6f 1800 4814 b685 5a5079a7a3da:soal Remdial Uas KimiaLatioganDocument10 pagesCf86ed6f 1800 4814 b685 5a5079a7a3da:soal Remdial Uas KimiaLatioganFarkhan SwastikoNo ratings yet
- UnsurDocument14 pagesUnsurBrenda KimNo ratings yet