Professional Documents
Culture Documents
Problemas de Materiales
Problemas de Materiales
Uploaded by
Andrea VillarOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Problemas de Materiales
Problemas de Materiales
Uploaded by
Andrea VillarCopyright:
Available Formats
C.F.G.S Laboratori d'Anàlisi i Control de Qualitat.
Mòdul 4. Assaigs físics.
UF1/NF2 Descripció de l’estructura dels materials
Problemes de cristal·lografia
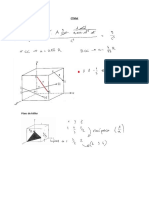
1.- Calcula la massa de coure a l'interior d'una cel·la elemental, centrat en les cares
(FCC)
R= 4,22.10-22 grams
2.- Calcula l'aresta del cub de la cel·la unitat del coure, centrat en les cares (FCC),
sabent que la densitat és de 8.96g/cm3.
R= 3,615.10-8 cm
3.- Calcula el nombre d'àtoms de coure en un cm3 d'aquest metall.
R= 8,49.1022 àtoms/cm3
4.- Determina la densitat del ferro, centrat en les cares, FCC i centrat en el cos BCC,
amb un paràmetre de xarxa de 2.866Å.
R= 7,9 grams/mL
5.- Calcula la densitat d'un aliatge de coure i alumini amb un 12% d’alumini.
R= 7,01grams/mL
6.- L’alumini cristal·litza en el sistema, centrat en les cares, FCC, calcula l’aresta del
cub i constant de cel·la unitat sabent que l'alumini té una densitat de 2.7g/cm3.
R= 4,048.10-8 cm = 4,048 Å
7.- Un metall cristal·litza en una estructura centrada en el cos, BCC. Per terme mig,
quants àtoms caben en la cel·la elemental? Si l'aresta mesura 4.24Å i el pes atòmic és
23, quina serà la densitat del metall?
R= 1,003grams/mL
8.- L’àtom d’or té un radi 1.44Å i es presenta formant una xarxa cúbica centrada en les
cares. Segons això, quina serà la longitud de l'aresta de la cel·la unitat?
R= 4,07.10-8cm
9.- L’aresta de la unitat cristal·logràfica FCC del NaCl mesura 5.63Å. Calcula la
densitat del cristall de clorur de sodi.
R= 2,18 grams/mL
10.- La cel·la unitat del metall plata és una estructura cúbica centrada en les cares.
Calcula:
a) L’aresta de la cel·la unitat sabent que el radi atòmic de la plata és de 1,44 Å.
R=4,07. 10-8cm
b) El volum d’un àtom de plata. R=12,50. 10-24cm3
c) % de volum de la cel·la unitat ocupat pels àtoms o factor d’empaquetament.
R=74,2%
d) % buit. R= 25,8%
e) densitat de la plata. R=10,62g/mL
Maria Josepa Alcaina
1
C.F.G.S Laboratori d'Anàlisi i Control de Qualitat.
Mòdul 4. Assaigs físics.
UF1/NF2 Descripció de l’estructura dels materials
Problemes de cristal·lografia
11.- El ferro a temperatura ambient presenta una estructura cúbica centrada en el cos
amb un paràmetre de xarxa de 2,87 Å. Sabent que la massa atòmica és de 55,8 gr/mol
Determina:
a) La massa d’un àtom. R= 9,27.10-23 grams/àtom
b) La densitat del ferro. R= 7843 Kg/m3
c) El radi atòmic del ferro. R= 1,24 Å
d) El volum atòmic. R= 7,98.10-30 m3
e) El nombre d’àtoms/m3. R= 8,46.1028 at/m3
f) El nombre d’àtoms/gram. R=1,08.1022 at/gram
g) El nombre de mols/ m3 R= 1,40.105 mols/m3
h) La massa de la cel·la unitària. R= 1,85.1022 grams/cel·la
i) El nombre de cel·les unitàries existents en 1 gram de ferro R= 5,39.1021 cel·les/gr
j) El volum d’una cel·la unitària. R= 2,36.10-29 m3
Maria Josepa Alcaina
2
You might also like
- REFORÇ 1a AVALUACIÓ 1r BATXDocument5 pagesREFORÇ 1a AVALUACIÓ 1r BATXtexida7864No ratings yet
- 02-Estructura Cristal Lina. Defectes (1a Part) FitxerDocument37 pages02-Estructura Cristal Lina. Defectes (1a Part) FitxerJohairo André Cedeño RodríguezNo ratings yet
- CTMat ExercicisDocument4 pagesCTMat ExercicisMiquel FiguerolaNo ratings yet
- CTM Grau Problemes v7Document15 pagesCTM Grau Problemes v7David Jean Rodriguez GavilanesNo ratings yet
- Exa 1btxDocument11 pagesExa 1btxjdiez6268No ratings yet
- CM - Problemes Tema 4Document2 pagesCM - Problemes Tema 4Ahlam HaddadiNo ratings yet
- PRÀCTICA 6 QuimicaDocument8 pagesPRÀCTICA 6 QuimicaPlastikman PghNo ratings yet
- Exercicis Química 2022-2023Document25 pagesExercicis Química 2022-2023Amaguna PagorNo ratings yet
- Extres Form Emp Ona Corpuscle Taula Period Atoms MolsDocument3 pagesExtres Form Emp Ona Corpuscle Taula Period Atoms MolsCarla lagunaNo ratings yet
- Full Repàs 1a Avlauació SOLUCIONSDocument11 pagesFull Repàs 1a Avlauació SOLUCIONSnachapalNo ratings yet
- 1r 1 2014 - 15 FetDocument4 pages1r 1 2014 - 15 FetGuillem VillalbaNo ratings yet
- L'àtomDocument2 pagesL'àtomFaniMilletNo ratings yet
- Exercicis Q1 U7 Models AtomicsDocument4 pagesExercicis Q1 U7 Models AtomicsPaula Raga RoperoNo ratings yet
- Còpia de ACTIVITATS Diversitat D'àtomsDocument5 pagesCòpia de ACTIVITATS Diversitat D'àtomsAya ElKhayat El KhayatNo ratings yet
- Copia de Solucionari Santillana Enllaç QuímicDocument22 pagesCopia de Solucionari Santillana Enllaç Químicnoracalvet06No ratings yet
- Preparació I Caracterització Del FerrocèDocument9 pagesPreparació I Caracterització Del FerrocèsaylaxNo ratings yet
- Metafisica 1 ALDAVEDocument12 pagesMetafisica 1 ALDAVEKevin AguirreNo ratings yet
- Possible ExamenDocument2 pagesPossible ExamenJuliaNo ratings yet
- Problemes Repàs de QuímicaDocument9 pagesProblemes Repàs de QuímicaRogerMiróRullNo ratings yet
- 1-Prob Lleis Ponderals Gasos I FormulesDocument5 pages1-Prob Lleis Ponderals Gasos I FormulesAndrea PomaresNo ratings yet
- Exercicis Selectivitat Model ActualDocument2 pagesExercicis Selectivitat Model ActualLiv GironNo ratings yet
- Exercicis DensitatDocument2 pagesExercicis DensitatNeus LluchNo ratings yet
- Exercicis DensitatDocument2 pagesExercicis DensitatJhonn AlejandroNo ratings yet
- 2005-04-01 (Solució) 1r Parcial AmbDocument3 pages2005-04-01 (Solució) 1r Parcial AmbericplazassimonNo ratings yet
- 2007-03-30 Solucions 1r ParcDocument3 pages2007-03-30 Solucions 1r ParcericplazassimonNo ratings yet
- 9-Problemes Proposats Tema 9 SolucionsDocument2 pages9-Problemes Proposats Tema 9 SolucionsJordi FargasNo ratings yet
- Preguntes Materials Sense RespostesDocument10 pagesPreguntes Materials Sense ResposteskikaaguiloNo ratings yet
- Ejercicios TMA Final de 2023Document27 pagesEjercicios TMA Final de 2023FranlyLuhanNo ratings yet
- REFORÇ 2a AVALUACIÓ 1r BATX 2024Document4 pagesREFORÇ 2a AVALUACIÓ 1r BATX 2024texida7864No ratings yet
- Exercicis Interacció Radiació-MatèriaDocument6 pagesExercicis Interacció Radiació-MatèriaJaime Carrero FernándezNo ratings yet
- Q. Puresa I Rendiment (2024) - I I IIDocument2 pagesQ. Puresa I Rendiment (2024) - I I IIAdria FernandezNo ratings yet
- Exercicis Tema 5Document2 pagesExercicis Tema 5Ferran Cordoba del CuraNo ratings yet
- Problemas Ingeniería MaterialesDocument9 pagesProblemas Ingeniería MaterialesÁngel BermúdezNo ratings yet
- Guia de Treball D'estiu Física I Química 2022-23 4t ESODocument4 pagesGuia de Treball D'estiu Física I Química 2022-23 4t ESOGuillem Ortega AparicioNo ratings yet
- TECNOLOGIA INDUSTRIAL 1r BATXILLERATDocument17 pagesTECNOLOGIA INDUSTRIAL 1r BATXILLERATroger.masdefiolNo ratings yet
- EXERCICIS QUANTITAT DE SUBSTÀNCIA 1r BATXILLERATDocument2 pagesEXERCICIS QUANTITAT DE SUBSTÀNCIA 1r BATXILLERATlaura11223344No ratings yet
- Física ModernaDocument10 pagesFísica ModernaFederico EspindolaNo ratings yet
- Unitat 2 Estructura Atòmica I Sistema PeriòdicDocument23 pagesUnitat 2 Estructura Atòmica I Sistema PeriòdicVentas RP TecnologíaNo ratings yet
- Cas Pràctic 3 - Corrosió Cable23 - 24Document3 pagesCas Pràctic 3 - Corrosió Cable23 - 24dani gómez jiménezNo ratings yet
- Exercicis Estructura AtòmicaDocument2 pagesExercicis Estructura Atòmicalaia.gavaldaNo ratings yet
- Exercicis de Selectivitat de Propietats PeriòdiquesDocument4 pagesExercicis de Selectivitat de Propietats Periòdiquesbruna dedesNo ratings yet
- Quimica2BatDossier 03-10Document44 pagesQuimica2BatDossier 03-10ixidionNo ratings yet
- Solucionari Estructura de LaDocument15 pagesSolucionari Estructura de Laabril.geladaNo ratings yet
- Activitat Metalls PDFDocument3 pagesActivitat Metalls PDFAbril A20 Coll BorrasNo ratings yet
- Examen Fisica Selectivitat 2023 070623Document16 pagesExamen Fisica Selectivitat 2023 070623Pere Egolatra AlterNo ratings yet
- Problemes Repas de Quimica PDF FreeDocument9 pagesProblemes Repas de Quimica PDF FreeJan LlorensNo ratings yet
- Problemari PauDocument61 pagesProblemari PauIan BowenNo ratings yet
- Exercicis Propietats Periã DiquesDocument3 pagesExercicis Propietats Periã DiquesPAU YI RAMOSNo ratings yet
- U7 PDFDocument6 pagesU7 PDFCarles Alcaide BlayaNo ratings yet
- Problemes de Viscositat 1Document2 pagesProblemes de Viscositat 1Maria Quesada BrunaNo ratings yet
- Exercicis Química InorgànicaDocument4 pagesExercicis Química InorgànicaevaNo ratings yet
- Problemes de Fisica QuànticaDocument3 pagesProblemes de Fisica QuànticaMònica Cabanillas DiéguezNo ratings yet
- Exercicis X Practicar - CompletDocument12 pagesExercicis X Practicar - Completarrandanner360No ratings yet
- Explorant La Taula Periòdica - Documents de GoogleDocument1 pageExplorant La Taula Periòdica - Documents de Google08alampreNo ratings yet
- Examens MolsDocument1 pageExamens MolsClaudia Avellana CazorlaNo ratings yet
- Exmane Tecno para Don Bosco Bien HechoDocument3 pagesExmane Tecno para Don Bosco Bien HechoArian cuenta de juegosNo ratings yet
- Tutoria1 ConceptesBasicsDocument1 pageTutoria1 ConceptesBasicsmaricha.en.cantarteNo ratings yet
- Fã Sica Nuclear PauDocument4 pagesFã Sica Nuclear PauJaume Vilchez MoliesNo ratings yet