Professional Documents
Culture Documents
تطبيق 04
تطبيق 04
Uploaded by
miss.academic.hopeCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
تطبيق 04
تطبيق 04
Uploaded by
miss.academic.hopeCopyright:
Available Formats
املدة1 :سا تمرين تطبيقي رقم 14
عند لحظة 𝑠 𝑡 = 0نمزج حجما 𝐿𝑚 𝑉1 = 50من محلول حمض األكساليك 𝐻2 𝐶2 𝑂4تركيزه المولي 𝐿𝐶1 = 80 𝑚𝑚𝑜𝑙/
مع محلول مائي لبرمنغنات البوتاسيوم) (𝐾 + + 𝑀𝑛𝑂4−المحمض ذو اللون البنفسجي حجمه 𝐿𝑚 ، 𝑉2 = 50و تركيزه المولي 𝐶2
التحول الحادث منمذج بمعادلة التفاعل التالية:
𝟓𝑯𝟐 𝑪𝟐 𝑶𝟒 + 𝟐𝑴𝒏𝑶− +
𝒏𝑴𝟐 = 𝑯𝟔 𝟒 +
𝟐+
𝑶 𝟐𝑯𝟖 + 𝟏𝟎𝑪𝑶𝟐 +
-1أكمل جدول تقدم التفاعل:
معادلة التفاعل 𝟓𝑯𝟐 𝑪𝟐 𝑶𝟒 + 𝟐𝑴𝒏𝑶−
𝑯𝟔 𝟒 +
+
𝑶 𝟐𝑯𝟖 = 𝟐𝑴𝒏𝟐+ + 𝟏𝟎𝑪𝑶𝟐 +
الحالة التقدم كمية المادة بالمول )(mol
-2اعتمادا على جدول تقدم التفاعل أثبت العالقات التالية:
[𝐻2 𝐶2 𝑂4 ] = 0.0.4− 50 𝑥
] 𝐶1 −5[𝑀𝑛2+
= ] [𝐻2 𝐶2 𝑂4
2
𝐶2 𝑉𝐶𝑂2
= ] [𝑀𝑛𝑂4− −
2 𝑇𝑉5.𝑉𝑀 .
[𝑴𝒏𝑶− 𝟏−
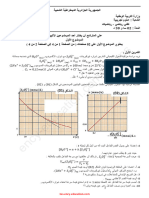
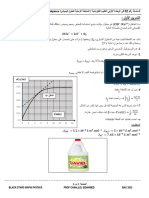
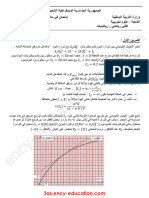
) 𝑳 𝟒 ](𝒎𝒎𝒐𝒍. -3المتابعة الزمنية لهذا التحول الكيميائي مكنتنا من رسم البيانين التاليين:
𝑳 𝟑𝑽(𝑪𝑶𝟐) 𝒎𝑳𝟏𝟎−
الشكل()1
الشكل()2
19.2
19.2 𝑳𝒎 )𝟐𝑶𝑪(𝑽 0
0 0.1 )𝒍𝒐𝒎𝒎(𝒙
أ-اعتمادا على البيانين أوجد :التقدم األعظمي 𝑥𝑎𝑚𝑥 ،المتفاعل المحد (دون حساب) ،التركيز االبتدائي 𝐶2
ب-أوجد سلم رسم لمحور التراتيب في الشكل()2
ب-أوجد الحجم المولي للغازات في شروط التجربة بطريقتين.
-4استنتج تراكيز األنواع الكيميائية عند نهاية التفاعل.
-5ما هو لون المزيج في نهاية التفاعل؟
-6ما هو الحجم الواجب اضافته من محلول برمنغنات البوتاسيوم كي يستهلك الحمض كليا؟
You might also like
- 44alfiziaa Oalkimiaa Alom Fiziaiia 2018 Aldora Alistdrakia AltshihDocument10 pages44alfiziaa Oalkimiaa Alom Fiziaiia 2018 Aldora Alistdrakia AltshihYoussef YoussefNo ratings yet
- Corppcr 18Document10 pagesCorppcr 18wadiaaboulqassimNo ratings yet
- !!Document4 pages!!bouthinaaanrNo ratings yet
- Ficher 23Document3 pagesFicher 23DEBLOFNo ratings yet
- فرض الثالثة نهائي علميDocument1 pageفرض الثالثة نهائي علميnacima.gdppNo ratings yet
- Alttba Alzmni Lthol Kimiaii Sraa Altfaal Tshih Slsla Altmarin 3Document7 pagesAlttba Alzmni Lthol Kimiaii Sraa Altfaal Tshih Slsla Altmarin 3Ibrahím LaâmëchNo ratings yet
- الامتحان الوطني في الفيزياء والكيمياء 2019 للمسالك العلمية الدورة الاستدراكيةDocument13 pagesالامتحان الوطني في الفيزياء والكيمياء 2019 للمسالك العلمية الدورة الاستدراكية05313893731llllNo ratings yet
- سلسلة تمارين1 في الأكسدة ارجاع وتقدم التفاعل بكالورياDocument1 pageسلسلة تمارين1 في الأكسدة ارجاع وتقدم التفاعل بكالورياKhalid100% (1)
- Bac Hebdo 13Document2 pagesBac Hebdo 13Lydia AmiratNo ratings yet
- تصحيح 2016Document8 pagesتصحيح 2016Tarik SouimdiNo ratings yet
- الوحدة 01 سلسلة 02 السنة ثالثةDocument1 pageالوحدة 01 سلسلة 02 السنة ثالثةÊš Pőîř100% (1)
- Physics 3mtm22 1trim d4Document4 pagesPhysics 3mtm22 1trim d4Radovane PhysiqyeNo ratings yet
- Physics 3se22 1trim d1Document4 pagesPhysics 3se22 1trim d1souissi souissiNo ratings yet
- الوحدة 01 سلسلة 01 السنة ثالثةDocument2 pagesالوحدة 01 سلسلة 01 السنة ثالثةÊš PőîřNo ratings yet
- 3as تصحيح إختبار الفصل الأولDocument5 pages3as تصحيح إختبار الفصل الأولKANIKI FFNo ratings yet
- ________ (12) _____ ___ ________ _______ __ ____ ____ _____ (1)Document5 pages________ (12) _____ ___ ________ _______ __ ____ ____ _____ (1)Abderrahman NemerNo ratings yet
- الوحدة 01 سلسلة تمارين حصص zoomDocument4 pagesالوحدة 01 سلسلة تمارين حصص zoomferiel taibiNo ratings yet
- الوحدة 01 سلسلة المتابعة الزمنية عن طريق قياس الحجمDocument2 pagesالوحدة 01 سلسلة المتابعة الزمنية عن طريق قياس الحجمZizo Dark100% (2)
- حقيبة الأستاذ قزوري في الفيزياء بكالوريا 2020Document91 pagesحقيبة الأستاذ قزوري في الفيزياء بكالوريا 2020طارق أبومعاوية الجزائري احتياطيةNo ratings yet
- Almaaira Alhmdhia Alqaadia Tshih Slsla Altmarin 1Document11 pagesAlmaaira Alhmdhia Alqaadia Tshih Slsla Altmarin 1user1899casaNo ratings yet
- - - - - - - - - الحلقة (10) تمرين حول المتابعة الزمنية عن طريق قياس الضغط PDFDocument5 pages- - - - - - - - الحلقة (10) تمرين حول المتابعة الزمنية عن طريق قياس الضغط PDFamina derkaouiNo ratings yet
- - - - - - - - - الحلقة (10) تمرين حول المتابعة الزمنية عن طريق قياس الضغط PDFDocument5 pages- - - - - - - - الحلقة (10) تمرين حول المتابعة الزمنية عن طريق قياس الضغط PDFAbdou100% (1)
- التمرين الاول 2021Document1 pageالتمرين الاول 2021Dh SilaNo ratings yet
- 4 5879874055732990293Document5 pages4 5879874055732990293Loup le DésertNo ratings yet
- السلسلة رقم 02 في الوحدة الأولىDocument4 pagesالسلسلة رقم 02 في الوحدة الأولىzineeddine0750No ratings yet
- الأسئلة الشائعة للوحدة الأولىDocument8 pagesالأسئلة الشائعة للوحدة الأولىchhaidar28No ratings yet
- Corppcr 17Document11 pagesCorppcr 17اوىةNo ratings yet
- سلسلة تمارين 2Document6 pagesسلسلة تمارين 2lisaNo ratings yet
- سلسلة تمارينDocument6 pagesسلسلة تمارينMalak ElaichouchiNo ratings yet
- تقويم الوحدة 2024Document4 pagesتقويم الوحدة 2024widad doudiNo ratings yet
- Série 3 $ Suivi Temporel D'une Transformation 2bac ArDocument4 pagesSérie 3 $ Suivi Temporel D'une Transformation 2bac ArAyoub ImgirneNo ratings yet
- 22اختبار تجريبي 02Document2 pages22اختبار تجريبي 02Brahim MerakchiNo ratings yet
- سلسلة تمارينDocument5 pagesسلسلة تمارينayadilyes79No ratings yet
- سلسلة تمارين 1Document5 pagesسلسلة تمارين 1lisaNo ratings yet
- 42alfiziaa Oalkimiaa Alom Fiziaiia 2018 Aldora Alaadia AltshihDocument6 pages42alfiziaa Oalkimiaa Alom Fiziaiia 2018 Aldora Alaadia AltshihYoussef YoussefNo ratings yet
- Ttba Thol Kimiaii Tshih Slsla Altmarin 1 3Document8 pagesTtba Thol Kimiaii Tshih Slsla Altmarin 1 3Amine AlaoUii AlaouiNo ratings yet
- Alttba Alzmni Lthol Kimiaii Sraa Altfaal Aldrs 2Document9 pagesAlttba Alzmni Lthol Kimiaii Sraa Altfaal Aldrs 2ilyass kannaniNo ratings yet
- Alfiziaa Oalkimiaa Alom Fiziaiia 2010 Aldora Alaadia Altshih 3Document9 pagesAlfiziaa Oalkimiaa Alom Fiziaiia 2010 Aldora Alaadia Altshih 3Adil BahriNo ratings yet
- حل تمارين المعايرة اللونية 3 ثانويDocument10 pagesحل تمارين المعايرة اللونية 3 ثانويsafaamoudjari38No ratings yet
- الأسئلة الشائعة في الوحدة الأولى وأجوبتها في مادة الفيزياء للسنة الثالثة ثانوي الشعب العلميةDocument8 pagesالأسئلة الشائعة في الوحدة الأولى وأجوبتها في مادة الفيزياء للسنة الثالثة ثانوي الشعب العلميةAna Oum AwladiNo ratings yet
- العلاقة بين الأفراد الكيميائيةDocument3 pagesالعلاقة بين الأفراد الكيميائيةlynamellah415No ratings yet
- 32alfiziaa Oalkimiaa Alom Fiziaiia 2015 Aldora Alistdrakia Altshih 1Document7 pages32alfiziaa Oalkimiaa Alom Fiziaiia 2015 Aldora Alistdrakia Altshih 1Youssef YoussefNo ratings yet
- سلسلة تمارين متعلقة بالمكتسبات القبليةDocument2 pagesسلسلة تمارين متعلقة بالمكتسبات القبليةBOUCHEFFA HalimNo ratings yet
- - - - - الحلقة (8) تمرين حول المتابعة الزمنية عن طريق المعايرة اللونيةDocument6 pages- - - - الحلقة (8) تمرين حول المتابعة الزمنية عن طريق المعايرة اللونيةAbdou0% (2)
- درس المتابعة الزمنية عن طريق المعايرة اللونيةDocument3 pagesدرس المتابعة الزمنية عن طريق المعايرة اللونيةRedouane Reda75% (4)
- الحلقة (7) درس المتابعة الزمنية عن طريق المعايرة اللونية PDFDocument3 pagesالحلقة (7) درس المتابعة الزمنية عن طريق المعايرة اللونية PDFu w uNo ratings yet
- حل تمارين الناقلية. - استعد باكpdfDocument23 pagesحل تمارين الناقلية. - استعد باكpdfĂð ĘmNo ratings yet
- حل تمارين الناقلية. - استعد باكpdfDocument23 pagesحل تمارين الناقلية. - استعد باكpdfSe LmaNo ratings yet
- فرض منزلي 2رقم 1الدورة الثانيةDocument1 pageفرض منزلي 2رقم 1الدورة الثانيةSHOUBAKINo ratings yet
- فرض منزلي 2رقم 1الدورة الثانيةDocument1 pageفرض منزلي 2رقم 1الدورة الثانيةSHOUBAKINo ratings yet
- Physics 3se20 1trim5Document3 pagesPhysics 3se20 1trim5louaiboualleg570No ratings yet
- Rapport TP1 Physique MateriauxDocument3 pagesRapport TP1 Physique MateriauxMaroua MerNo ratings yet
- Examens Nationaux 2bac Science Mathematiques PC 2015 NormaleDocument17 pagesExamens Nationaux 2bac Science Mathematiques PC 2015 NormaleFatima Larhmicذڤ1قhNo ratings yet
- الامتحان الوطني في الفيزياء والكيمياء 2015 مسلك علوم رياضية الدورة العاديةDocument17 pagesالامتحان الوطني في الفيزياء والكيمياء 2015 مسلك علوم رياضية الدورة العاديةnasrelhassakNo ratings yet
- Bbl14bS MohamedDocument9 pagesBbl14bS MohamedrachidNo ratings yet
- Alfiziaa Oalkimiaa Alom Riadhia 2016 Aldora Alaadia Altshih 2Document14 pagesAlfiziaa Oalkimiaa Alom Riadhia 2016 Aldora Alaadia Altshih 2Oussama cr97No ratings yet
- ملخص السنة الثانية #مجال #المادة وتحولاتهاDocument6 pagesملخص السنة الثانية #مجال #المادة وتحولاتهاtouhami messiidNo ratings yet
- سلسلة اليوتيوب الوحدة 1Document8 pagesسلسلة اليوتيوب الوحدة 1Kerboub IdrisNo ratings yet
- Dzexams 3as Physique d2 20181 719755Document3 pagesDzexams 3as Physique d2 20181 719755yacine yacineNo ratings yet