Professional Documents
Culture Documents
Alttba Alzmni Lthol Kimiaii Sraa Altfaal Aldrs 2
Uploaded by
ilyass kannaniOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Alttba Alzmni Lthol Kimiaii Sraa Altfaal Aldrs 2
Uploaded by
ilyass kannaniCopyright:
Available Formats
التتبع الزمني لتحول كيميائي -سرعة التفاعل الكيمياء مادة العلوم الفيزيائية
الجزء األول :
التحوالت السريعة
التتبع الزمين لتحول كيميائي -سرعة التفاعل
والبطيئة لمجموعة
كيميائية Suivi temporel d'une transformation -
الوحدة 2 الثانية باكالوريا
4س
Vitesse de réaction الكيمياء
-1التتبع الزمني لتحول كيميائي:
تهدف الحركية الكيميائية إلى تتبع تطور تحول كيميائي ،وخاصة إلى تحديد التقدم )𝒕(𝒇 = 𝒙 .
لهذا الغرض تعتمد طرق فيزيائية وكيميائية :
الطرق الفيزيائية تستعمل عندما تكون بعض المقادير الفيزيائية القابلة للقياس في وسط تفاعلي مرتبطة
بتركيز بعض األنواع الكيميائية المتواجدة في هذا الوسط ،نذكر منها :قياس المواصلة – قياس - pH
قياس الحجم أو الضغط – قياس الطيف الضوئي .تتميز هذه الطرق بتسجيل مستمر لتطور كمية مادة أو
تراكيز متفاعل أو ناتج خالل الزمن ،وهي سريعة ودون التشويش على الوسط التفاعلي .
وهناك طرق كيميائية كالمعايرة .وهذه الطرق ال تسمح بتسجيل مستمر لتطور كمية مادة أو تركيز
متفاعل أو ناتج خالل الزمن .
-2تتبع التطور الزمني لتحول كيميائي :
-1-2تتبع التطور الزمني لمجموعة كيميائية بواسطة المعايرة :
-1-1-2التفاعل بين أيونات اليودور والماء األوكسجيني :
نصب في كأس ،حجما من محلول الماء األوكسجيني
𝟐𝐎 𝟐𝑯 (عديم اللون) تركيزه 𝟏𝑪 = 𝟎, 𝟐𝟎 𝒎𝒐𝒍. 𝑳−
وبضع قطرات من حمض الكبريتيك المركز ،ثم نضيف إليه
𝑲+ −
حجما من محلول يودور البوتاسيوم )𝒒𝒂(𝑰 (𝒂𝒒) +
(عديم اللون) تركيزه 𝟏 ، 𝑪′ = 𝟎, 𝟐𝟎 𝒎𝒐𝒍. 𝑳−بعد
التحريك ،نالحظ أن الخليط يأخذ تدريجيا لون أصفر ( أ ) ،
ثم بنيا ( ب ) ليصبح بعد بضع دقائق داكنا ( ج ) .
أ -ما هو النوع الكيميائي المسؤول عن اللون المالحظ ؟ كيف تفسر تطور اللون ؟
اللون الذي يظهر يميز )𝒒𝒂( 𝟐𝑰 ،ويفسر تزايد شدة اللون بتزايد تركيز )𝒒𝒂( 𝟐𝑰 .
ب -عين المزدوجتين مختزل /مؤكسد المتدخلتين في التفاعل الحاصل .
المزدوجتان مختزل /مؤكسد المتدخلتان في التفاعل الحاصل هما 𝑯𝟐 𝐎𝟐 (𝐚𝐪) / 𝑯𝟐 𝑶(𝒍) :و
. 𝑰𝟐 (𝒂𝒒) / 𝑰−
)𝒒𝒂(
ج -اكتب معادلة التفاعل الحاصل .
𝑯𝟐 𝐎𝟐 (𝐚𝐪) + 𝟐 𝑯+
𝒆 𝟐 (𝒂𝒒) +
−
)𝒍(𝑶 𝟐𝑯 𝟐 ⇌
𝟐 𝑰−
)𝒒𝒂( ⇌ 𝑰𝟐 (𝒂𝒒) + 𝟐 𝒆−
𝑯𝟐 𝐎𝟐 (𝐚𝐪) + 𝟐 𝑰− +
)𝒍(𝑶 𝟐𝑯 𝟐 (𝒂𝒒) + 𝟐 𝑯(𝒂𝒒) → 𝑰𝟐 (𝒂𝒒) +
د -ماهو النوع الكيميائي المذاب الذي يمكن معايرته ؟
يمكن معايرة )𝒒𝒂( 𝟐𝑰 عند لحظة معينة .
1 ذ .هشام محجر
التتبع الزمني لتحول كيميائي -سرعة التفاعل الكيمياء مادة العلوم الفيزيائية
-2-1-2تحديد كمية مادة ثنائي اليود عند لحظة معينة :
نصب في كأس 𝑳𝒎 𝟎𝟎𝟏 = 𝑽 من محلول يودور
البوتاسيوم تركيزه 𝟏 ، 𝑪𝟏 = 𝟎, 𝟒𝟎𝟎 𝒎𝒐𝒍. 𝑳−ونضيف
إليه 𝑳𝒎 𝟎𝟎𝟏 = 𝑽 من محلول بيروكسو ثنائي كبريتات
𝟐𝑲+تركيزه 𝟐−
البوتاسيوم )𝒒𝒂(𝟖𝑶 𝟐𝑺 (𝒂𝒒) +
𝟏 𝑪𝟐 = 𝟎, 𝟎𝟑𝟔 𝒎𝒐𝒍. 𝑳−محمض ب 𝑳𝒎 𝟏 من
محمض الكبريتيك المركز .
′
فورا ،عند تحضير الخليط ،نأخذ منه 𝑳𝒎 𝟎𝟏 = 𝑽
ونصبها في كأس عند اللحظة 𝟎 = 𝒕 ،ونضيف إلى هذه
الكأس 𝑳𝒎 𝟎𝟓 من الماء المثلج )𝑪.(𝟎 °
نعاير ثنائي اليود المتكون عند لحظة 𝒕 بمحلول ثيوكبريتات
𝟐𝑵𝒂+تركيزه المولي 𝑳 . 𝑪𝟑 = 𝟎, 𝟎𝟐𝟎 𝒎𝒐𝒍.
𝟏− 𝟐−
الصوديوم )𝒒𝒂(𝟑𝑶 𝟐𝑺 (𝒂𝒒) +
نعيد نفس العمليات السابقة بالنسبة للحظات أخرى ،كما يوضح الجدول التالي :
60 50 40 30 20 16 12 9 6 3 0 )t( min
3,3 3,2 3,1 2,8 2,3 2,1 1,7 1,4 1,0 0,5 0,0 n(I2)t mmol
أ -لماذا نصب العينة من الخليط التفاعلي في الماء المثلج قبل كل معايرة ؟
تسمى هذه العملية الغطس ،والهدف منها هو توقيف التفاعل بالتخفيف والتبريد .
ب -أنشئ جدول التقدم لتفاعل أيونات بيروكسو ثنائي كبريتات وأيونات اليودور .
𝟐 𝑰−
)𝒒𝒂( ⇌ 𝑰𝟐 (𝒂𝒒) + 𝟐 𝒆−
𝐒𝟐 𝐎𝟖𝟐−
)𝒒𝒂(
+ 𝟐 𝒆− ⇌ 𝟐 𝐒𝐎𝟐−
)𝐪𝐚( 𝟒
𝟐−
𝟐 𝑰−
)𝒒𝒂( 𝟖𝐎 𝟐𝐒 (𝒂𝒒) + → 𝑰𝟐 (𝒂𝒒) + 𝟐 𝐒𝐎𝟐−
المعادلة الحصيلة 𝟒 (𝐚𝐪) :
جدول التقدم :
𝟐 𝑰−
)𝒒𝒂( + 𝐒𝟐 𝐎𝟖 𝟐−
)𝒒𝒂( → 𝑰𝟐 (𝒂𝒒) + 𝟐 𝐒𝐎𝟐−
)𝐪𝐚( 𝟒
معادلة التفاعل
كميات المادة بالمول التقدم حالة المجموعة
n1= c1.v n2= c2.v 0 0 0 الحالة البدئية
c1.v – 2x c2.v - x x 2x )x(t خالل التحول
c1.v – 2xf c2.v – xf xf 2 xf xf الحالة النهائية
ج -ماهي العالقة بين كمية ثنائي اليود المتكونة عند لحظة tوتقدم التفاعل xعند نفس اللحظة ؟
من خالل جدول التقدم ،نجد )𝒕(𝒙 = 𝒕) 𝟐𝑰(𝒏 .
د -كيف يمكن تتبع التطور الزمني لهذا التحول الكيميائي ؟
𝐒𝟐 𝐎𝟐−من تتبع تطور تقدم التفاعل xخالل الزمن tتمكن معايرة ثنائي اليود 𝟐𝑰 بأيونات ثيوكبريتات 𝟑
،وبالتالي حساب كميات مادة المكونات األخرى للوسط التفاعلي عند كل لحظة ، tحيث :
𝟐− −
𝒏( 𝑺𝑶𝟐− 𝒙𝟐 – 𝑽 𝟒 (𝒂𝒒) ) = 𝟐𝒙 ; 𝒏(𝑺𝟐 𝑶𝟖 (𝒂𝒒) ) = 𝑪𝟐 . 𝑽 – 𝒙 ; 𝒏(𝑰(𝒂𝒒) ) = 𝑪𝟏 .
2 ذ .هشام محجر
التتبع الزمني لتحول كيميائي -سرعة التفاعل الكيمياء مادة العلوم الفيزيائية
ه -أنشئ جدول التقدم لتفاعل المعايرة بين أيونات ثيو كبريتات وأيونات ثنائي اليود .
𝟐 𝐒𝟐𝐎𝟐−
)𝐪𝐚( 𝟑 ⇌ 𝐒𝟒 𝐎𝟔 𝟐−
)𝒒𝒂(
+ 𝟐 𝒆−
𝑰𝟐 (𝒂𝒒) + 𝟐 𝒆− ⇌ 𝟐 𝑰−
)𝒒𝒂(
𝟐−
𝑰𝟐 (𝒂𝒒) + 𝟐 𝐒𝟐 𝐎𝟐−
)𝐪𝐚( 𝟑 → 𝟐 𝑰−
)𝒒𝒂( 𝟔𝐎 𝟒𝐒 (𝒂𝒒) +
جدول التقدم :
𝟐−
)𝒒𝒂( 𝟐𝑰 + 𝟐 𝐒𝟐 𝐎𝟐−
)𝐪𝐚( 𝟑 → 𝟐 𝑰−
)𝒒𝒂( 𝟔𝐎 𝟒𝐒 (𝒂𝒒) +
معادلة التفاعل
كميات المادة بالمول حالة المجموعة التقدم
)n’p(I2 n3= c3.vE n0 0 0 الحالة البدئية
n’p(I2) – x c3.vE - 2x n0 + 2x x )x(t خالل التحول
n’p(I2) – xE c3.vE – 2xE n0 + 2xE xE xE الحالة النهائية
𝑰−الموجودة في العينة المعايرة .حيث 𝟎𝒏 كمية مادة )𝒒𝒂(
𝑬𝑽 والتركيز المولي 𝟑𝑪 و -عبر عن كمية مادة ثنائي اليود المتكونة ) 𝟐𝑰( 𝒑 𝒏′بداللة الحجم المكافئ
لمحلول ثيوكبريتات الصوديوم .
𝑬𝑽 𝟑𝑪
= ) 𝟐𝑰( 𝒑 ، 𝒙𝑬 = 𝒏′وبما أن حجم الخليط التفاعلي يساوي عشر مرات عند التكافؤ ،لدينا
𝟐
حجم العينة المأخوذة (المعايرة) ،فإن كمية مادة ثنائي اليود المتكونة عند لحظة معينة في الخليط التفاعلي
هي 𝒏𝒑 (𝑰𝟐 ) = 𝟏𝟎 𝒏′𝒑 (𝑰𝟐 ) = 𝟓𝑪𝟑 𝑽𝑬 :
ز -خط المنحى )𝒕(𝒇 = 𝒙 :
خالصة :
تمكن المعايرة من تتبع تطور تقدم تفاعل xخالل الزمن ،حيث يمكن حساب xفي كل لحظة انطالقا
من معرفة كمية مادة أحد المتفاعالت أو النواتج المتكونة عند هذه اللحظة .
3 ذ .هشام محجر
التتبع الزمني لتحول كيميائي -سرعة التفاعل الكيمياء مادة العلوم الفيزيائية
-2-2تتبع التطور الزمني لمجموعة كيميائية بإنجاز قياس فيزيائي :
-1-2-2تتبع تحول كيميائي بقياس ضغط غاز :
ندخل في حوجلة متصلة بمانومتر حجما 𝑳𝒎 𝟎 𝑽 = 𝟓𝟎,من
محلول حمض الكلوريدريك تركيزه 𝟏𝑪 = 𝟎, 𝟓 𝒎𝒐𝒍. 𝑳−
وكتلة 𝒈 𝟎𝟐𝟎 𝒎 = 𝟎,من المغنيزيوم .
نعطي 𝟏. 𝑴(𝑴𝒈) = 𝟐𝟒, 𝟑𝒈. 𝒎𝒐𝒍−
نسجل قيمة الضغط بعد تمام كل 𝒔 𝟎𝟑 .
أ -اكتب معادلة التفاعل الحاصل .
)P (hPa )t (s 𝐌𝐠 𝟐+و
المزدوجتان المتدخلتان في التفاعل هما (𝐚𝐪) / 𝑴𝒈(𝐬) :
1013 0 . 𝑯𝟑 𝑶+إذن معادلة التفاعل الحاصل :
)𝒈( 𝟐𝑯 (𝒂𝒒) /
1025 30 𝑴𝒈(𝒔) + 𝟐𝑯𝟑 𝑶+ 𝟐+
)𝒍(𝑶 𝟐𝑯𝟐 (𝒂𝒒) → 𝑴𝒈(𝒂𝒒) + 𝑯𝟐 (𝒈) +
1036 60
1048 90 ب -احسب كميات المادة البدئية للمتفاعالت .
1060 120 𝟓𝟎 𝒏𝒊 (𝑯𝟑 𝑶 = [𝑯𝟑 𝑶+ ]. 𝑽 = 𝒄. 𝑽 = 𝟎, 𝟓 × 𝟎,
)+
1068 150 𝒍𝒐𝒎𝒎 𝟓𝟐 = ) 𝒏𝒊 (𝑯𝟑 𝑶+
1079 180 )𝒈𝑴(𝒎 𝟎𝟐𝟎𝟎,
= )𝒈𝑴( 𝒊𝒏 = 𝒍𝒐𝒎𝒎 𝟐𝟖 = 𝟎,
)𝒈𝑴(𝑴 𝟑𝟐𝟒,
1081 210
1087 240 ج -حدد المتفاعل المحد و قيمة التقدم األقصى .
) 𝒏𝒊 (𝑯𝟑 𝑶+ )𝒈𝑴( 𝒊𝒏
1091 270 ،إذن المتفاعل المحد هو )𝐬(𝒈𝑴 > لدينا
𝟐 𝟏
1093 300 )𝒈𝑴( 𝒊𝒏
1093 330 = 𝐦𝒙 . والتقدم األقصى هو 𝒍𝒐𝒎𝒎 𝟐𝟖 = 𝟎,
𝟏
د -أنشئ جدول التقدم لهذا التفاعل .
𝑴𝒈(𝒔) + 𝟐𝑯𝟑 𝑶+ 𝟐+
)𝒍(𝑶 𝟐𝑯𝟐 (𝒂𝒒) → 𝑴𝒈(𝒂𝒒) + 𝑯𝟐 (𝒈) +
معادلة التفاعل
كميات المادة ب )(mmol حالة المجموعة التقدم
0,82 25 0 0 بوفرة 0 الحالة البدئية
)0,82– x(t )25 - 2x(t )x(t )x(t بوفرة )x(t خالل التحول
0 23,4 0,82 0,82 بوفرة xmax الحالة النهائية
ه -ينتج عن هذا التفاعل ،غاز ثنائي الهيدروجين ،مما يؤدي إلى تزايد الضغط داخل حوجلة حجمها ثابت.
يقيس المانومتر الضغط داخل الحوجلة 𝑷 = 𝑷𝒂𝒕𝒎 + 𝜟𝑷 :حيث 𝒎𝒕𝒂𝑷 يمثل الضغط الجوي
أوجد العالقة بين تغير الضغط 𝑷𝜟 للغاز داخل الحوجلة وتقدم التفاعل 𝒙 (نعتبر الغاز كامال) .
𝑻𝑹.
𝑷𝒂𝒕𝒎 = 𝒏𝟎 .حيث 𝟎𝒏 كمية المادة لألنواع المتواجدة في الهواء . في الحالة البدئية ،لدينا
𝑽
𝑻𝑹. 𝑻𝑹. 𝑻𝑹. 𝑻𝑹.
𝑷 = (𝒏𝟎 + 𝒏(𝑯𝟐 )). = 𝒏𝟎 . + 𝒏(𝑯𝟐 ). = 𝑷𝒂𝒕𝒎 + 𝒏(𝑯𝟐 ). خالل التحول
𝑽 𝑽 𝑽 𝑽
𝑻𝑹. 𝑻𝑹.
)𝟏( 𝜟𝑷 = 𝒏(𝑯𝟐 ). = 𝒙(𝒕). إذن وبما أن )𝒕(𝒙 = ) 𝟐𝑯(𝒏
𝑽 𝑽
𝑻𝑹.
)𝟐( 𝜟𝑷𝒎𝒂𝒙 = 𝒙𝒎𝒂𝒙 . في الحالة النهائية ،لدينا
𝑽
4 ذ .هشام محجر
التتبع الزمني لتحول كيميائي -سرعة التفاعل الكيمياء مادة العلوم الفيزيائية
𝑻𝑹.
)𝟏( 𝑷𝜟 𝒙(𝒕). )𝒕(𝒙
= 𝑽
𝑻𝑹. = من ( )1و ( )2نستنتج
)𝟐( 𝒙𝒂𝒎𝜟 𝒙𝒎𝒂𝒙 . 𝒙𝒂𝒎𝒙
𝑽
𝑷𝜟
𝒙(𝒕) = 𝒙𝒎𝒂𝒙 . إذن
𝒙𝒂𝒎𝑷𝜟
مع 𝒍𝒐𝒎𝒎 𝟐𝟖 𝒙𝐦 = 𝟎,و 𝒂𝑷𝒉 𝟑𝟏𝟎𝟏 = 𝒎𝒕𝒂𝑷 و 𝒂𝑷𝒉 𝟎𝟖 = 𝒎𝒕𝒂𝑷 𝜟𝑷𝒎𝒂𝒙 = 𝑷 −
و -احسب )𝒕(𝒙 في مختلف اللحظات .
)x (mmol )t (s
انظر جانبه
0 0
0,12 30
0,24 60
0,36 90
0,48 120
0,56 150
0,64 180 ز -خط المنحنى )𝒕(𝒇 = 𝒙 .
0,70 210
0,76 240
0,80 270
0,82 300
0,82 330
مثال :حدد تركيب الخليط عند اللحظة . t = 150 s
𝟓𝟓
(𝟏𝟓𝟎) = 𝟎, 𝟖𝟐. 𝟏𝟎−𝟑 . لدينا 𝒂𝑷𝒉 𝟓𝟓 = 𝟑𝟏𝟎𝟏 𝜟𝑷 = 𝟏𝟎𝟔𝟖 −إذن 𝒍𝒐𝒎𝒎 𝟔𝟓 = 𝟎,
𝟎𝟖
و بالتالي :
2+
n ( H2 ) = n( Mg ) = 0,56 mmol
n ( H3O+ ) = ( 25- 2 × 0,56 ) . 10-3 = 23,88 mmol
n ( Mg ) = ( 0,82 – 0,56 ) . 10-3 = 0,26 mmol
خالصة :
يمكن قياس ضغط غاز من تتبع بكيفية مستمرة ،تطور تقدم التفاعل بداللة الزمن .
5 ذ .هشام محجر
التتبع الزمني لتحول كيميائي -سرعة التفاعل الكيمياء مادة العلوم الفيزيائية
-2-2-2تتبع تحول كيميائي بقياس الموصلية :
نصب في كأس 𝟓𝟎 𝒎𝑳 ،من الماء المقطر و 𝑳𝒎 𝟓𝟐 من الكحول ،ونضع
الكأس في حمام مريم درجة حرارته ℃𝟎𝟐 .ثم نضيف إليه 𝑳𝒎 𝟏 من -2
كلورو -2-مثيل بروبان ( 𝒍𝒐𝒎 𝟑 ) 𝒏𝟎 = 𝟗, 𝟐. 𝟏𝟎−ونرمز له بـ 𝒍𝑪𝑹 .
نعير مقياس المواصلة و نغمر خلية القياس في الخليط بعد تحريكه .ونسجل بعد
تمام كل 𝒔 𝟎𝟎𝟐 ،الموصلية )𝐭(𝛔 للمحلول كما يبين الجدول أسفله.
2000 1800 1600 1400 1200 1000 800 600 400 200 0 )t(s
)1,955 1,955 1,905 1,856 1,759 1,661 1,466 1,270 0,977 0,489 0 σ(S/m
أ -اكتب معادلة التفاعل الحاصل .
)𝒍(𝑶 𝟐𝑯 𝑹𝑪𝒍 + → 𝑹𝑶𝑯 + 𝑯+ )𝒒𝒂(𝒍𝑪 (𝒂𝒒) +
−
ب -أنشئ جدول التقدم للتفاعل الحاصل .
)𝒍(𝑶 𝟐𝑯 𝑹𝑪𝒍 + → 𝑹𝑶𝑯 + 𝑯+ −
)𝒒𝒂(𝒍𝑪 (𝒂𝒒) +
معادلة التفاعل
كميات المادة ب )(mol حالة المجموعة التقدم
n0 بوفرة 0 0 0 0 الحالة البدئية
)n0– x(t بوفرة )x(t )x(t )x(t )x(t خالل التحول
n0– xmax بوفرة xmax xmax xmax xmax الحالة النهائية
بما أن الماء موجود بوفرة ،فإن المتفاعل المحد هو 𝒍𝑪𝑹 والتقدم األقصى هو 𝒍𝒐𝒎𝒎 𝟐 𝒙𝒎𝒂𝒙 = 𝒏𝟎 = 𝟗,
ج -هل تتغير موصلية المحلول .
− +
يؤدي التفاعل إلى تكون األيونات )𝒒𝒂(𝑯 و )𝒒𝒂(𝒍𝑪 التي تزيد من موصلية الوسط التفاعلي .
د -أوجد العالقة بين )𝒕(𝒙 و )𝒕(𝝈 .
يعبر عن موصلية المحلول عند اللحظة tبالعالقة 𝝈(𝒕) = 𝝀𝑯+ . [𝑯+ ]𝒕 + 𝝀𝑪𝒍− . [𝑪𝒍− ]𝒕 :
)𝒕(𝒙
= 𝒕] [𝑯+ ]𝒕 = [𝑪𝒍− حسب جدول التقدم لدينا :
𝑽
)𝒕(𝒙
)𝟏( 𝝈(𝒕) = (𝝀𝑯+ + 𝝀𝑪𝒍− ). يبقى حجم المحلول ثابتا ،إذن
𝑽
𝒙𝒂𝒎𝒙
(𝟐) 𝝈(𝒕𝒇 ) = 𝝈𝒎𝒂𝒙 = (𝝀𝑯+ + 𝝀𝑪𝒍− ). عندما يصل التحول إلى الحالة النهائية ،لدينا :
𝑽
)𝟏( )𝒕(𝝈 )𝒕(𝒙
= من خالل العالقتين نجد :
)𝟐( 𝒙𝒂𝒎𝝈 𝒙𝒂𝒎𝒙
)𝒕(𝝈
𝒙(𝒕) = 𝒙𝒎𝒂𝒙 .مع 𝒍𝒐𝒎𝒎 𝟐 𝒙𝒎𝒂𝒙 = 𝒏𝟎 = 𝟗,و 𝟏𝝈𝒎𝒂𝒙 = 𝟏, 𝟗𝟓𝟓 𝑺. 𝒎− إذن
𝒙𝒂𝒎𝝈
ه -احسب 𝒙 عند مختلف اللحظات .
2000 1800 1600 1400 1200 1000 800 600 400 200 0 )t(s
9,20 9,20 8,96 8,73 8,62 7,82 6,90 5,98 4,60 )2,30 0 x(mmol
6 ذ .هشام محجر
التتبع الزمني لتحول كيميائي -سرعة التفاعل الكيمياء مادة العلوم الفيزيائية
و -خط المنحنى )𝒕(𝒇 = 𝒙 .
خالصة :
يمكن قياس الموصلية ) σ (tلمحلول أيوني ،من تتبع ،بكيفية مستمرة ،تقدم التفاعل بالنسبة
للتفاعالت التي يكون خاللها الفرق بين الموصلية المولية للنواتج والموصلية المولية للمتفاعالت مهما .
-3سرعة التفاعل وزمن نصف التفاعل :
-1-3سرعة التفاعل :
-1-1-3تعريف :
𝒙𝒅 𝟏
= ) 𝒊𝒕(𝝂 ) ( السرعة الحجمية νلتفاعل عند اللحظة tiهي :
𝒊𝒕 𝒕𝒅 𝑽
𝒙𝒅
تغير تقدم التفاعل بالنسبة للزمن ) 𝟏(𝒎𝒐𝒍. 𝒔− مع 𝑽 حجم المحلول ) 𝟑𝒎( و
𝒕𝒅
𝟏𝒎𝒐𝒍. 𝒎−𝟑 . 𝒔− وحدة السرعة الحجمية للتفاعل في ( ن.ع ) هي
-2-1-3تحديد السرعة الحجمية :
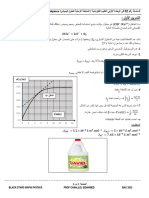
الطريقة المبيانية :نخط المنحنى )𝒕(𝒇 = 𝒙 ثم
نرسم المماس للمنحنى )𝒕(𝒇 = 𝒙 عند اللحظة 𝒕 ثم
نحسب المعامل الموجه لهذا المماس ثم نقسمه على
حجم المحلول .
استعمال مجدول :انطالقا من قيم 𝒙 و 𝒕 و 𝝂 عند
مختلف اللحظات .
-3-1-3تطور سرعة التفاعل :
نالحظ تناقص الزاوية 𝜶 فتتناقص قيم المعامل الموجه
للمماس 𝜶 𝒏𝒂𝒕 أثناء تطور التحول خالل الزمن ،
وبما أن التحول يتم في حجم ثابت فإن سرعة التفاعل
تتناقص خالل الزمن .
7 ذ .هشام محجر
التتبع الزمني لتحول كيميائي -سرعة التفاعل الكيمياء مادة العلوم الفيزيائية
-2-3زمن نصف التفاعل :
-1-2-3تعريف :
، 𝒕𝟏⁄المدة الزمنية الالزمة ليأخذ تقدم التفاعل 𝒙 نصف قيمته النهائية نسمي زمن نصف التفاعل
𝟐
𝒇𝒙
= ) . 𝒙 (𝒕𝟏⁄ 𝒇𝒙 أي :
𝟐 𝟐
ملحوظة :
في حالة التفاعل الكلي ،يكون زمن نصف التفاعل هو المدة الزمنية الالزمة الختفاء نصف الكمية البدئية
𝒙𝒂𝒎𝒙
= ) . 𝒙 (𝒕𝟏⁄ للمتفاعل المحد .أي :
𝟐 𝟐
-1-2-3تحديد زمن نصف التفاعل :
نحدده مبيانيا انطالقا من منحنى تغيرات تقدم التفاعل :
نحدد قيمة التقدم النهائي xfبخط مقارب للمنحنى .
𝒇𝒙
. تحديد
𝟐
𝒇𝒙
مع المنحنى . تحديد نقطة تقاطع الخط األفقي لألرتوب
𝟐
تحديد أفصول نقطة التقاطع .
ملحوظة :
أثناء التتبع الزمني للتحول ،يجب أن تكون المدة الزمنية بين كل قياسين أصغر بكثير من زمن
نصف التفاعل 𝒕𝟏⁄لضمان سالمة الدراسة .
𝟐
يمكن زمن نصف التفاعل من تقييم المدة الزمنية الالزمة النتهاء التحول الكيميائي المدروس
. ) 𝒕𝒇 = 𝟏𝟎 𝒕𝟏⁄ ( حوالي 𝟎𝟏 مرات 𝒕𝟏⁄أي
𝟐 𝟐
8 ذ .هشام محجر
التتبع الزمني لتحول كيميائي -سرعة التفاعل الكيمياء مادة العلوم الفيزيائية
-4التفسير الميكروسكوبي ( :خاص ع .ف و ع .ر )
-1-4االرتجاج الحراري :
إن الكيانات الكيميائية ( ذرات ،جزيئات ،أيونات ) المتواجدة في مائع تتحرك بسرعة وبصفة دائمة
وعشوائية ،مما يجعلها تتصادم بتردد مرتفع ،وينتج عن هذه التصادمات تحول كيميائي .فكلما ارتفعت
درجة الحرارة كلما زادت قيم سرعات األنواع الكيميائية و تردد تصادماتها .
مثال :نعتبر الخليط متكونا من جزيئات A2و ، B2تمكن التصادمات المتعددة بين هذه الجزيئات من
تحويلها إلى جزيئات 𝑩𝑨 .لكي يكون التصادم فعاال أي لكي تتكون الجزيئات 𝑩𝑨 ،يجب كسر الرابطة
𝑨 𝑨 −والرابطة 𝑩 𝑩 −لتكون رابطتين 𝑩 . 𝑨 −إن كسر هذه الروابط يستلزم توفير كمية كافية
من الطاقة .وإذا كانت كمية الطاقة المتوفرة غير كافية يكون التصادم غير فعال .
تصادم غير فعال :الطاقة المتوفرة غير كافية لكسر تصادم فعال :الطاقة المتوفرة كافية لكسر
الرابطتين A—Aو . B—B الرابطتين A—Aو . B—B
تتكون المادة من كيانات مجهرية في حركة دائمة .إنها ظاهرة االرتجاج الحراري .لكي يتفاعل كيانان
متصادمان ،يجب أن يتوفرا على طاقة كافية .نقول إن التصادم فعال .
-2-4سرعة التحول و العوامل الحركية :
تتعلق سرعة التفاعل باحتمال حدوث تصادم فعال بين الكيانات المتفاعلة خالل مدة زمنية معينة .كلما كان
هذا االحتمال كبيرا كلما كانت سرعة التفاعل مرتفعة .
-1-2-4تأثير التركيز البدئي :
يزيد تردد التصادمات عندما يزيد عدد الكيانات الكيميائية المتواجدة في حجم معين ،وبالتالي يزيد احتمال
حدوث تصادم فعال .وهكذا كلما كان تركيز المتفاعالت مرتفعا كلما كانت سرعة التفاعل كبيرة .
-2-2-4تأثير درجة الحرارة :
يرتفع االرتجاج الحراري ،عند ارتفاع درجة حرارة مجموعة كيميائية ،مما يؤدي إلى تزايد تردد
التصادمات بين الكيانات الكيميائية ،باإلضافة إلى ارتفاع سرعة هذه الكيانات أي إلى الزيادة في طاقتها
الحركية ،الشيء الذي يزيد من احتمال حدوث تصادمات فعالة .وهكذا كلما كانت درجة الحرارة مرتفعة
كلما كانت سرعة التفاعل كبيرة .
9 ذ .هشام محجر
You might also like
- الاختبار بالحلgDocument13 pagesالاختبار بالحلgاستاذك في الفيزياءNo ratings yet
- التتبع الزمني لتحول كيميائي - سرعة التفاعل-الأنشطة1Document4 pagesالتتبع الزمني لتحول كيميائي - سرعة التفاعل-الأنشطة1Mostafa ELJETTINo ratings yet
- 4 5879874055732990293Document5 pages4 5879874055732990293Loup le DésertNo ratings yet
- التتبع الزمني لتحول كميائي سرعة التفاعلDocument10 pagesالتتبع الزمني لتحول كميائي سرعة التفاعلalmuslim80% (5)
- - نماذج احيائي منهج عربي 4Document4 pages- نماذج احيائي منهج عربي 4hassanghfran283No ratings yet
- سلسلة تمارين1 في الأكسدة ارجاع وتقدم التفاعل بكالورياDocument1 pageسلسلة تمارين1 في الأكسدة ارجاع وتقدم التفاعل بكالورياKhalid100% (1)
- Série 3 $ Suivi Temporel D'une Transformation 2bac ArDocument4 pagesSérie 3 $ Suivi Temporel D'une Transformation 2bac ArAyoub ImgirneNo ratings yet
- 1 6Document5 pages1 6azizNo ratings yet
- الواجب المنزلي 03Document2 pagesالواجب المنزلي 03karim KhaledNo ratings yet
- سلسلة تمارين 2Document6 pagesسلسلة تمارين 2lisaNo ratings yet
- سلسلة تمارينDocument6 pagesسلسلة تمارينMalak ElaichouchiNo ratings yet
- الوحدة 01 سلسلة 01 السنة ثالثةDocument2 pagesالوحدة 01 سلسلة 01 السنة ثالثةÊš PőîřNo ratings yet
- SerieDocument2 pagesSerieAnass El OualiNo ratings yet
- سلسلة تمارين 1Document5 pagesسلسلة تمارين 1lisaNo ratings yet
- التمرين الاول 2021Document1 pageالتمرين الاول 2021Dh SilaNo ratings yet
- Physics 3se22 1trim2Document2 pagesPhysics 3se22 1trim2yacine yacineNo ratings yet
- - سلسلة تمارين في تعيين كمية المادة بواسطة المعايرة أكسدة - إرجاع للسنة 2 الشعب العلمية للاستاذ التيجاني دهامDocument2 pages- سلسلة تمارين في تعيين كمية المادة بواسطة المعايرة أكسدة - إرجاع للسنة 2 الشعب العلمية للاستاذ التيجاني دهامBessekri BessekriNo ratings yet
- سلسلة الوحدة 1 المتابعة الزمنيةDocument8 pagesسلسلة الوحدة 1 المتابعة الزمنيةMohamed Anis LounisNo ratings yet
- Bac2023 Ytb Unite 01 01Document1 pageBac2023 Ytb Unite 01 01Taki PhysiqueNo ratings yet
- سلسلة تمارين المكتسبات القبلية 2022Document7 pagesسلسلة تمارين المكتسبات القبلية 2022Miss MNo ratings yet
- Physics 3mtm22 1trim1Document2 pagesPhysics 3mtm22 1trim1yacine yacineNo ratings yet
- Dzexams Docs 2as 906595Document3 pagesDzexams Docs 2as 906595Chi KouNo ratings yet
- 3AS U01 - E3 - Cour-Exe 02 Backup BackupDocument38 pages3AS U01 - E3 - Cour-Exe 02 Backup BackupYacine Mohamed0% (1)
- (الفرض الأول (3ر+تقرDocument2 pages(الفرض الأول (3ر+تقرNasser Eddine AbdouNo ratings yet
- اختبار للفصل الثاني سنة ثانية تقني الحل رياضيDocument6 pagesاختبار للفصل الثاني سنة ثانية تقني الحل رياضيdfdfdfNo ratings yet
- الوثيقة 2araDocument2 pagesالوثيقة 2araSoumia KerdNo ratings yet
- الوثيقة 2Document2 pagesالوثيقة 2Soumia KerdNo ratings yet
- الوحدة 01 سلسلة تمارين حصص zoomDocument4 pagesالوحدة 01 سلسلة تمارين حصص zoomferiel taibiNo ratings yet
- الوحدة 01 السلسلة 01Document3 pagesالوحدة 01 السلسلة 01Manil FélixNo ratings yet
- Almaairat Almbashra Tmarin Ghir Mhlola 1 4Document2 pagesAlmaairat Almbashra Tmarin Ghir Mhlola 1 4Mohammed SmadiNo ratings yet
- Dev113Ter RachidDocument3 pagesDev113Ter RachidSawssen BáràNo ratings yet
- Suivi TemporelDocument3 pagesSuivi Temporelmourafiq faysal100% (1)
- Physics 2se20 2trim1Document4 pagesPhysics 2se20 2trim1noureddine SILININo ratings yet
- units PHYSICS REVISION 3AS ZDN سلسلة التمارين 02Document2 pagesunits PHYSICS REVISION 3AS ZDN سلسلة التمارين 02Melki AmeurNo ratings yet
- Physics 3mtm22 1trim d4Document4 pagesPhysics 3mtm22 1trim d4Radovane PhysiqyeNo ratings yet
- Physics 3se22 1trim d1Document4 pagesPhysics 3se22 1trim d1souissi souissiNo ratings yet
- 22اختبار تجريبي 02Document2 pages22اختبار تجريبي 02Brahim MerakchiNo ratings yet
- dzexams-2as-physique-2432286Document7 pagesdzexams-2as-physique-2432286allaouaassilNo ratings yet
- Alttba Alzmni Lthol Kimiaii Sraa Altfaal Tmarin Ghir Mhlola 3Document2 pagesAlttba Alzmni Lthol Kimiaii Sraa Altfaal Tmarin Ghir Mhlola 3Abdellah FaqdaniNo ratings yet
- Alttba Alzmni Lthol Kimiaii Sraa Altfaal Tmarin Ghir Mhlola 3Document2 pagesAlttba Alzmni Lthol Kimiaii Sraa Altfaal Tmarin Ghir Mhlola 3Abdellah FaqdaniNo ratings yet
- الوحدة 01 سلسلة 02 السنة ثالثةDocument1 pageالوحدة 01 سلسلة 02 السنة ثالثةÊš Pőîř100% (1)
- Altholat Alkimiaiia Alti THDTH Fi Mnhiin Aldrs 2Document7 pagesAltholat Alkimiaiia Alti THDTH Fi Mnhiin Aldrs 2Kasper KasparovNo ratings yet
- Bbl14bS MohamedDocument9 pagesBbl14bS MohamedrachidNo ratings yet
- Dzexams Docs 3as 907415Document5 pagesDzexams Docs 3as 907415abdouh4214No ratings yet
- Exc7 1bac PDFDocument4 pagesExc7 1bac PDFSouhail Alessandro67% (3)
- Composition de Physique 3AS - Sujet 04Document2 pagesComposition de Physique 3AS - Sujet 04Hasan RajawiNo ratings yet
- ملخص السنة الثانية #مجال #المادة وتحولاتهاDocument6 pagesملخص السنة الثانية #مجال #المادة وتحولاتهاtouhami messiidNo ratings yet
- Bac Hebdo 13Document2 pagesBac Hebdo 13Lydia AmiratNo ratings yet
- Acide BaseDocument2 pagesAcide Baseayman lamzouriNo ratings yet
- Resu Chap 01daoudiDocument9 pagesResu Chap 01daoudidaoudiNo ratings yet
- سلسلة المكتسبات القبلية 2023 (جبالي رفيق)Document3 pagesسلسلة المكتسبات القبلية 2023 (جبالي رفيق)Hina BouzerzourNo ratings yet
- السلسلة رقم 02 في الوحدة الأولىDocument4 pagesالسلسلة رقم 02 في الوحدة الأولىzineeddine0750No ratings yet
- ملخص المكتسبات القبلية للسنة الثالثة ثانويDocument4 pagesملخص المكتسبات القبلية للسنة الثالثة ثانويTrainerYoucefDjouadjNo ratings yet
- Physics 2mtm22 2trim5Document6 pagesPhysics 2mtm22 2trim5mohamed benmouloudNo ratings yet
- ExamsDocument1 pageExamsyacine yacineNo ratings yet
- فرض الثالثة نهائي علميDocument1 pageفرض الثالثة نهائي علميnacima.gdppNo ratings yet
- !!Document4 pages!!bouthinaaanrNo ratings yet