Professional Documents
Culture Documents
23 B
Uploaded by
api-270998884Original Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
23 B
Uploaded by
api-270998884Copyright:
Available Formats
ЕТРИ
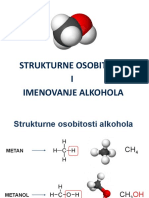
Општа формула етара је R – O – R’, R – O – Ar, Ar – O – Ar. Етри имају исту молекулску формулу као алкохоли, али
различиту структуру и особине – етри и алкохоли су структурни изомери.
Номенклатура етара
Имена се најчешће дају тако да се именима две угљоводоничне групе које су повезане преко кисеоника додаје реч
етар. Уколико једна од угљоводоничних група има компликованије име етри се именују као алкокси-деривати
одређеног једињења. Симетрични етри имају исте угљоводоничне групе везане преко кисеоника, а асиметрични
различите. Код симетричних етара треба навести само име угљоводоничне групе и реч етар (није потребно испред
имена угљоводоничне групе наводити грчки префикс „ди“ који је био обавезан по застарелој номенклатури). Ова класа
једињења је добила име по најпознатијем представнику класе етил-етру (некада само етар).
Физичке особине етара
мали диполни момент (мала поларност)
Молекули етара не могу међусобно да се повезују водоничним везама (молекули нису асосовани), па имају
релативно ниске ТТ и ТК (ТК отприлике као алкани исте Mr), знатно ниже од одговарајућх алкохола.
Растворљивост у води је слична као код алкохола исте Mr (граде водоничне везе са молекулима воде).
Етри су важни органски растварачи. Етил-етар је познати анестетик и важан растварач.
Добијање етара
- Дехидратација алкохола
- Из алкил-халогенида и алкоксида
Хемијске особине етара
Алифатични етри на ваздуху прелазе у нестабилне пероксиде (експлозивни су чак и у малим концентрацијама).
Етри су релативно нереактивна једињења. Етарска веза је отпорна према базама и нередукујућим средствима, а
подлеже једино цепању помоћу киселина.
- Цепање помоћу киселина
- Супституција код ароматичних етара
Епоксиди су посебна врста цикличних етара који су врло реактивни. Садрже трочлани епоксидни прстен који лако
пуца.
You might also like
- Hemija - Skripte - Sve Za Koricenje - Crno-Belo Sa PitanjimaDocument184 pagesHemija - Skripte - Sve Za Koricenje - Crno-Belo Sa Pitanjimaapi-270998884No ratings yet
- Alkoholi - Organska Hemija - Hemijska JedinjenjaDocument56 pagesAlkoholi - Organska Hemija - Hemijska JedinjenjaMaturski Rad HemijaNo ratings yet
- Test Hemija 13Document4 pagesTest Hemija 13disneycoolNo ratings yet
- V Vezbe Heterogene Ravnoteze 1417514894563 PDFDocument7 pagesV Vezbe Heterogene Ravnoteze 1417514894563 PDFljdespNo ratings yet
- 08 - Halogeni ElementiDocument13 pages08 - Halogeni ElementiMladen Krstic100% (1)
- Organska Hemija - Skripte - Za FrizereDocument45 pagesOrganska Hemija - Skripte - Za Frizereapi-270998884No ratings yet
- Neorganska Hemija - Za FrizereDocument40 pagesNeorganska Hemija - Za Frizereapi-270998884No ratings yet
- Hemija-10.vezba 2013 PDFDocument34 pagesHemija-10.vezba 2013 PDFVanroNo ratings yet
- ETRIDocument1 pageETRIEddie McCleisterNo ratings yet
- 21Document4 pages21api-270998884No ratings yet
- Organska Jedinjenja Sa SumporomDocument16 pagesOrganska Jedinjenja Sa SumporomRadica Miljkovic100% (1)
- Red-Ox - Lekcija Za Sajt Za FrizereDocument5 pagesRed-Ox - Lekcija Za Sajt Za Frizereapi-270998884No ratings yet
- OksidoredukcijaDocument5 pagesOksidoredukcijaNatalija JovanovićNo ratings yet
- Plan BiohemijaDocument8 pagesPlan BiohemijaАлександар ПејчићNo ratings yet
- 3Document2 pages3api-270998884No ratings yet
- Aldehidi KetoniDocument2 pagesAldehidi Ketoniapi-270998884No ratings yet
- Test EDocument5 pagesTest EJelena SavicNo ratings yet
- 16. Група (Viа) - Халкогени Елементи 16. Група (Viа) - Халкогени Елементи 16. Група (Viа) - Халкогени ЕлементиDocument5 pages16. Група (Viа) - Халкогени Елементи 16. Група (Viа) - Халкогени Елементи 16. Група (Viа) - Халкогени Елементиapi-270998884No ratings yet
- 5 PredavanjeDocument38 pages5 PredavanjeMarija VeselinovicNo ratings yet
- Hemija-5.vezba 2013 PDFDocument52 pagesHemija-5.vezba 2013 PDFVanroNo ratings yet
- ЗАКОН СТАЛНИХ ОДНОСА МАСАDocument1 pageЗАКОН СТАЛНИХ ОДНОСА МАСАMilorad ZelenovicNo ratings yet
- HemijaDocument29 pagesHemijaanon_300656446No ratings yet
- KompleksiDocument27 pagesKompleksiDejan MiticNo ratings yet
- Prijemni Test Iz Hemije I Biologije Sa Resenjima 2019Document14 pagesPrijemni Test Iz Hemije I Biologije Sa Resenjima 2019Ce RisNo ratings yet
- Vezbanje Opsta Rastvori 2Document3 pagesVezbanje Opsta Rastvori 2Lela SNo ratings yet
- Amini I Nitro JedinjenjaDocument4 pagesAmini I Nitro JedinjenjaRadica MiljkovicNo ratings yet
- FENOLIDocument1 pageFENOLIEddie McCleisterNo ratings yet
- хемијске реакцијеDocument3 pagesхемијске реакцијеMilorad ZelenovicNo ratings yet
- Parcijalni TestDocument3 pagesParcijalni TestbibaribaNo ratings yet
- Organska Jedinjenja Sa SumporomDocument6 pagesOrganska Jedinjenja Sa SumporomVesna MartinovicNo ratings yet
- Протолитичка теорија (Brönsted-Lowry-јева теорија) Протолитичка теорија (Brönsted-Lowry-јева теорија) Протолитичка теорија (Brönsted-Lowry-јева теорија)Document3 pagesПротолитичка теорија (Brönsted-Lowry-јева теорија) Протолитичка теорија (Brönsted-Lowry-јева теорија) Протолитичка теорија (Brönsted-Lowry-јева теорија)api-270998884No ratings yet
- N Jedinjenja 2-3Document4 pagesN Jedinjenja 2-3Vaso MuharemovicNo ratings yet
- 2.proba 1-9+14,15Document3 pages2.proba 1-9+14,15draganaNo ratings yet
- Alkoholi Alkilhalogenidi Fenoli EtriDocument1 pageAlkoholi Alkilhalogenidi Fenoli EtriaszmagNo ratings yet
- Zadaci Za PrijemniDocument52 pagesZadaci Za PrijemniMatthew BaileyNo ratings yet
- Kemija 4 Razred Gimnazije Sažetak ALDEHIDI, Ketoni, Esteri Karboksilne Kiseline, AmidiDocument1 pageKemija 4 Razred Gimnazije Sažetak ALDEHIDI, Ketoni, Esteri Karboksilne Kiseline, AmidirtdtNo ratings yet
- Veliki Test Opsta-NeorganskaDocument4 pagesVeliki Test Opsta-NeorganskadraganaNo ratings yet
- Karboksilne KiselineDocument4 pagesKarboksilne Kiselineapi-270998884No ratings yet
- OksidiDocument7 pagesOksidiMilica Rančić100% (1)
- Квиз Знања Из Хемије - 2022.Document3 pagesКвиз Знања Из Хемије - 2022.Маринко ЗубићNo ratings yet
- Apendix - Hemija ElemenataDocument85 pagesApendix - Hemija ElemenataDesa MišljenovićNo ratings yet
- Elektrolitic48dka Disocijacija I PH Vrednost ZadaciDocument1 pageElektrolitic48dka Disocijacija I PH Vrednost ZadaciDragan GligorovNo ratings yet
- Zadaci Za Vezbanje Azot I FosforDocument2 pagesZadaci Za Vezbanje Azot I FosforKristina FilipovićNo ratings yet
- AlkoholiDocument5 pagesAlkoholiVaso Muharemovic0% (1)
- Stehiometrija 28.5.2020Document1 pageStehiometrija 28.5.2020Miloš MarkovićNo ratings yet
- VIII Organska Kiseonicna JedinjenjaDocument4 pagesVIII Organska Kiseonicna JedinjenjaTanjaNo ratings yet
- Kolokvijumi NeorganskaDocument10 pagesKolokvijumi NeorganskaBranislavaNo ratings yet
- Nemetali Hemija Test 3Document1 pageNemetali Hemija Test 3Anastasija Kukoska JovanoskaNo ratings yet
- Hemijski Zakoni PrezentacijaDocument41 pagesHemijski Zakoni PrezentacijaNataša StevanovićNo ratings yet
- ЗАКОН СТАЛНИХ ОДНОСА МАСАDocument1 pageЗАКОН СТАЛНИХ ОДНОСА МАСАMilorad ZelenovicNo ratings yet
- Hemija 7 Hemijska IzračunavanjaDocument1 pageHemija 7 Hemijska IzračunavanjaEvaNo ratings yet
- NeorganskaDocument2 pagesNeorganskasladjad83No ratings yet
- ПИСМЕНА ПРОВЈЕРА ЗНАЊА ИЗ ХЕМИЈЕ 9 аDocument2 pagesПИСМЕНА ПРОВЈЕРА ЗНАЊА ИЗ ХЕМИЈЕ 9 аMilorad ZelenovicNo ratings yet
- Zadaci4 PDFDocument2 pagesZadaci4 PDFAnonymous EbYcyTNo ratings yet
- HemijaDocument49 pagesHemijaNikola MicicNo ratings yet
- EtriDocument6 pagesEtriSemija JahićNo ratings yet
- Fenoli I EteriDocument5 pagesFenoli I EteriJason JohnsonNo ratings yet
- Estri TioliDocument2 pagesEstri TioliOZRENAC TVNo ratings yet
- Etri (1) 1808327048Document12 pagesEtri (1) 1808327048Stefan IvanovicNo ratings yet
- Estri Karboksilnih KiselinaDocument10 pagesEstri Karboksilnih KiselinaBiljana PenjinNo ratings yet
- Alkoholi HemijaDocument3 pagesAlkoholi Hemijadijana9No ratings yet
- Alkoholi, Fenoli, EteriDocument45 pagesAlkoholi, Fenoli, EteriPetra PetraNo ratings yet
- Skripta AminiDocument7 pagesSkripta AminiUnicornNo ratings yet
- Hemija - Sistematizacija GradivaDocument8 pagesHemija - Sistematizacija Gradivaapi-270998884No ratings yet
- N азот P фосфор As арсен ns np Sb антимон Bi бизмутDocument5 pagesN азот P фосфор As арсен ns np Sb антимон Bi бизмутapi-270998884No ratings yet
- Hemija - Skripte - Za Citanje - Za FrizereDocument102 pagesHemija - Skripte - Za Citanje - Za Frizereapi-270998884No ratings yet
- 1Document2 pages1api-270998884No ratings yet
- Lekcija Za Sajt - Prelazni Elementi - Za FrizereDocument10 pagesLekcija Za Sajt - Prelazni Elementi - Za Frizereapi-270998884No ratings yet
- Hemija Prirodnih ProizvodaDocument23 pagesHemija Prirodnih Proizvodaapi-270998884No ratings yet
- Biomolekuli - Lekcija - FrizeriDocument16 pagesBiomolekuli - Lekcija - Frizeriapi-270998884No ratings yet
- Lekcija - Nukleinske Kiseline - Za Sajt FrizeriDocument3 pagesLekcija - Nukleinske Kiseline - Za Sajt Frizeriapi-270998884No ratings yet
- Opsta Hemija - Skripte - Za FrizereDocument23 pagesOpsta Hemija - Skripte - Za Frizereapi-270998884No ratings yet
- Lipidi - Lekcija I ZadaciDocument4 pagesLipidi - Lekcija I Zadaciapi-270998884No ratings yet
- Prelazni Elementi - Lekcija Za Sajt - Crno-BeloDocument11 pagesPrelazni Elementi - Lekcija Za Sajt - Crno-Beloapi-270998884No ratings yet
- 17. Група (Viiа) - Халогени Елементи 17. Група (Viiа) - Халогени Елементи 17. Група (Viiа) - Халогени ЕлементиDocument7 pages17. Група (Viiа) - Халогени Елементи 17. Група (Viiа) - Халогени Елементи 17. Група (Viiа) - Халогени Елементиapi-270998884No ratings yet
- F флуор Cl хлор Br бром ns np I јод At астатинDocument7 pagesF флуор Cl хлор Br бром ns np I јод At астатинapi-270998884No ratings yet
- SaharidiDocument6 pagesSaharidiapi-270998884No ratings yet
- 16. Група (Viа) - Халкогени Елементи 16. Група (Viа) - Халкогени Елементи 16. Група (Viа) - Халкогени ЕлементиDocument5 pages16. Група (Viа) - Халкогени Елементи 16. Група (Viа) - Халкогени Елементи 16. Група (Viа) - Халкогени Елементиapi-270998884No ratings yet