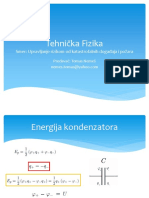
Professional Documents
Culture Documents
Квантно-механичка Теорија Атома
Uploaded by
Dragan Ristic0 ratings0% found this document useful (0 votes)
6 views11 pagesCopyright
© © All Rights Reserved
Available Formats
PPTX, PDF, TXT or read online from Scribd
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
© All Rights Reserved
Available Formats
Download as PPTX, PDF, TXT or read online from Scribd
0 ratings0% found this document useful (0 votes)
6 views11 pagesКвантно-механичка Теорија Атома
Uploaded by
Dragan RisticCopyright:
© All Rights Reserved
Available Formats
Download as PPTX, PDF, TXT or read online from Scribd
You are on page 1of 11
Квантно-механичка теорија атома
Ива Јордановић IV2
Шредингеровa једначинa
• Решавањем Шредингерове једначине могу да се добију
могућа стања атома.
• Када се у Шредингерову једначину замени вредност за
потенцијалну енергију електрона у електричном пољу
језгра атома водоника добијају се функције стања
електрона у водониковом атому. Свако стационарно
стање електрона одређено је са три квантна броја.
Поред главног квантног броја n, који се појављује у
Боровој теорији, за описивање стања електрона користе
се и орбитални (l) и магнетни (ml) квантни број.
Главни квантни број n
• Главни квантни број n (има слично значење као квантни
број n у Боровом моделу) одређује енергију стационарних
стања у атому водоника и може да има да има вредности n
= 1, 2, 3…
• Стања са различитим вредностима главног квантног броја
означавају се на следећи начин:
• главни квантни број 1 2 3 4 5 6 7
• ознака стања K L M N O P Q
Орбитални квантни број l
• Орбитални квантни број l одређује вредности орбиталног момента
импулса електрона на орбити око језгра. Момент импулса
кретања електрона око језгра може да има само одређене
вредности.
• Стања са различитим вредностима орбиталног квантног броја
означавају се на следећи начин:
Магнетни квантни број m
• Магнетни квантни број повезан је са магнетним моментом
електрона, који се јавља због његовог орбиталног кретања.
Вредност магнетног квантног броја одређује оријентацију
путање (орбите) у простору.
• Ако електрон у атому унесемо у спољашње магнетно
поље, па z – осу усмеримо у смер тог поља, тада магнетни
квантни број одређује z – пројекцију орбиталног момента
импулса:
• Магнетни квантни број може да има следеће
вредности:
• Магнетни квантни број може да има 2l+1
различитих вредности. То значи да се енергетски
ниво, одређен главним квантним бројем, цепа у
2l+1 енергетских поднивоа
• Према Шредингеровој једначини стање електрона у атому
одређено је са три квантна броја (о којима је било речи).
На основу експеримената закључено је да електрон има
још један момент импулса који је назван спин. У почетку се
мислило да је спин условљен обртањем електрона око
сопствене осе и да постоје две могућности његове ротације
– у смеру казаљке на сату и у супротном смеру од смера
кретања казаљке на сату. Огледи су показали да представа
о електрону као куглици која ротира око своје осе није
тачна. У обзир морају да се узму и његова таласна
својства.
Спински квантни број
• Спин треба схватити као унутрашње својство
електрона које електрон поседује, слично као
што има масу и наелектрисање. Спин нема
аналогију у макросвету.
• Спински квантни број, се добија решавањем
Диракове једначине која представља проширење
Шредингерове једначине. Спин ( спински квантни
број ) одређује сопствени момент импулса
електрона. Вредност спинског квантног броја је
s=1/2
• Вредност споственог момента импулса
електрона (аналогија са орбиталним
моментом импулса) је:
Mагненти спински квантни број
• По аналогији са магнетним квантним бројем, који има вредности –
• , може да се напише да су магнетни спински квантни број и
спински квантни број повезани на следећи начин:
• Магнетни спински квантни број електрона за сваку комбинацију
квантних бројева n, l и m може да има само две вредности:
ХВАЛА НА ПАЖЊИ!
You might also like
- Квантна Теорија Атома и МолекулаDocument16 pagesКвантна Теорија Атома и МолекулаDimitrije RadovanovicNo ratings yet
- Izgradnja Elektronskog OmotacaDocument15 pagesIzgradnja Elektronskog OmotacaMirkoNo ratings yet
- 3. Борови Постулати и Боров Модел АтомаDocument8 pages3. Борови Постулати и Боров Модел Атомаblablaa95No ratings yet
- Квантни бројевиDocument3 pagesКвантни бројевиGordana GordicNo ratings yet
- 11 Magnetni Moment AtomaDocument4 pages11 Magnetni Moment AtomaNemanja DakicNo ratings yet
- Izgradnja Elektronskog OmotacaDocument15 pagesIzgradnja Elektronskog OmotacaKerim PolutakNo ratings yet
- 7. Лоренцова силаDocument4 pages7. Лоренцова силаtonicmiraNo ratings yet
- Elektrotehnika Sa Elektronikom SkriptaDocument77 pagesElektrotehnika Sa Elektronikom SkriptaStefan StojanovicNo ratings yet
- Pojam Magnernog Polja. Magnetno Polje Provodnika Sa Strujom. Bio-Savarov I Amperov ZakonDocument5 pagesPojam Magnernog Polja. Magnetno Polje Provodnika Sa Strujom. Bio-Savarov I Amperov ZakonTamara ArsicNo ratings yet
- Jednosmerna Struja U MetalimaDocument8 pagesJednosmerna Struja U MetalimaH-Minka BesicNo ratings yet
- Питања из физикеDocument10 pagesПитања из физикеVukašinNo ratings yet
- Etf Dokument 9602Document31 pagesEtf Dokument 9602Marko ĆamilovićNo ratings yet
- Tehnička Fizika-P5Document41 pagesTehnička Fizika-P5Petar KnezevicNo ratings yet
- Борови постулатиDocument10 pagesБорови постулатиMarko AskovicNo ratings yet
- Izveštaj o Laboratorijskoj Vežbi: Univerzitet U Beogradu Fizički FakultetDocument7 pagesIzveštaj o Laboratorijskoj Vežbi: Univerzitet U Beogradu Fizički FakultetAleksa MiljkovićNo ratings yet
- ПотенцијалDocument10 pagesПотенцијалNenad Tamara KosticNo ratings yet
- Kvantna FizikaDocument7 pagesKvantna FizikaDragan KraljevicNo ratings yet
- Borov Model AtomaDocument9 pagesBorov Model AtomaMašaNo ratings yet
- Električno Polje. Napon. Veza Napona I Jačine El. Polja. Rad Sile El. PoljaDocument22 pagesElektrično Polje. Napon. Veza Napona I Jačine El. Polja. Rad Sile El. PoljaBiljana Panic100% (3)
- AkceleratoriDocument12 pagesAkceleratoriDejan MiticNo ratings yet
- Seminarski AtomiDocument10 pagesSeminarski AtomiWerdorPicturesNo ratings yet
- StatikaDocument20 pagesStatikaNikola LopacaninNo ratings yet
- 9 Kvantno-Mehanicka Teorija AtomaDocument10 pages9 Kvantno-Mehanicka Teorija AtomadamjanNo ratings yet
- Magnetno Polje Struje U Provodniku. Bio-Savarov ZakonDocument4 pagesMagnetno Polje Struje U Provodniku. Bio-Savarov ZakonImperator Taurunum Angles SvrcaNo ratings yet
- Elektrostatika Predavanje 1Document35 pagesElektrostatika Predavanje 1Petar SimonovicNo ratings yet
- 6AF41174-8610-4033-91AD-4E2587C60439Document45 pages6AF41174-8610-4033-91AD-4E2587C60439Sava SerdarNo ratings yet
- Elektrotehnika 1Document20 pagesElektrotehnika 1Milan RadinovicNo ratings yet
- 3.1.fizicki Osnovi ElektronikeDocument13 pages3.1.fizicki Osnovi Elektronikemingo622No ratings yet
- Predavanja ElektrostatikaDocument62 pagesPredavanja Elektrostatikadusankekic022_693705100% (1)
- Borov Model AtomaDocument7 pagesBorov Model AtomaOlivera ŽivojinovićNo ratings yet
- Faradejev Zakon Elektromagnetne IndukcijeDocument27 pagesFaradejev Zakon Elektromagnetne IndukcijeМилош ПавловићNo ratings yet
- ElectricitetDocument23 pagesElectricitetNemanja ĐinovićNo ratings yet
- ETH 1 - Kolokvijum 1Document24 pagesETH 1 - Kolokvijum 1Филип ТрајковићNo ratings yet
- Odgovori Na Pitanja 1Document4 pagesOdgovori Na Pitanja 1BobanNo ratings yet
- Seminarski ElektrotehnikaDocument12 pagesSeminarski ElektrotehnikaDragana JovanovićNo ratings yet
- Prezentacija Fizika 1Document9 pagesPrezentacija Fizika 1Ana KovacNo ratings yet
- Kvantni BrojeviDocument1 pageKvantni BrojeviОстоја КалабаNo ratings yet
- ⃗B ⃗B= F ⃗B=μ ∗⃗Document9 pages⃗B ⃗B= F ⃗B=μ ∗⃗Stef AnNo ratings yet
- Električni Potencijal I NaponDocument15 pagesElektrični Potencijal I Naponmladen978No ratings yet
- Jacina Elektricnog PoljaDocument1 pageJacina Elektricnog PoljaPetar CekicNo ratings yet
- BBB Tema NMR 2021Document55 pagesBBB Tema NMR 2021andrijanaNo ratings yet
- Potencijal Elektricnog Polja I Elektricni NaponDocument2 pagesPotencijal Elektricnog Polja I Elektricni NaponVisnja NikolicNo ratings yet
- ElektrostatikaDocument54 pagesElektrostatikaradomir46No ratings yet
- Atomska FizikaDocument4 pagesAtomska FizikamigebezbrigeNo ratings yet
- MagnetizamDocument19 pagesMagnetizamNikola LopacaninNo ratings yet
- Elektrostatika 1Document59 pagesElektrostatika 1АлександарСтанојевићNo ratings yet
- Tehnička Fizika-P6Document24 pagesTehnička Fizika-P6Petar KnezevicNo ratings yet
- Elektrostatika 4Document2 pagesElektrostatika 4Pavle JovanovićNo ratings yet
- Izvori Elektricne Struje I Elektromotorna SilaDocument3 pagesIzvori Elektricne Struje I Elektromotorna SilaDara RajkovicNo ratings yet
- Kulonov Zakon, Jacina Elektrostatickog PoljaDocument9 pagesKulonov Zakon, Jacina Elektrostatickog PoljaBojanNo ratings yet
- ЕлектростатикаDocument3 pagesЕлектростатикаGoran NikolićNo ratings yet
- 2 Jacina Elektricnog Polja Linije PoljaDocument1 page2 Jacina Elektricnog Polja Linije PoljaMilan PricaNo ratings yet
- Eld Zad 1213Document20 pagesEld Zad 1213Antonija KrstićNo ratings yet
- Електрична струјаDocument8 pagesЕлектрична струјаmilica sivcevicNo ratings yet
- 6 +predavanjeDocument5 pages6 +predavanjeMaja RatkovicNo ratings yet
- Slajdovi-Elektromagnetika-Elektrotehnicki Fakultet EM02 Elektrostatika PDFDocument63 pagesSlajdovi-Elektromagnetika-Elektrotehnicki Fakultet EM02 Elektrostatika PDFdukassNo ratings yet
- Elektrotehnika Odlicna Skripta!!!Document62 pagesElektrotehnika Odlicna Skripta!!!mladjura100% (1)