Professional Documents
Culture Documents
Proba de Aula Números Cuánticos Grupo 1
Uploaded by
JOSE DOMINGOCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Proba de Aula Números Cuánticos Grupo 1
Uploaded by
JOSE DOMINGOCopyright:
Available Formats
Proba de aula: números cuánticos 29/10/2023
Nome e apelidos: Nota:
1.- Xustifica se son posibles as seguintes combinacións de números cuánticos para un
electrón nun átomo:
a) (2,0,0,-1/2)
b) ( 3,1,-2,1/2)
O estado cuántico dos electróns situados nos átomos quedan caracterizados (definidos) en dito átomo polos
valores dos seus catro números cuánticos: (n,l,m,s)
Onde:
• n é o número cuántico principal e toma valores dende 1,2,3,4...ata ∞
Representa o volume efectivo do orbital e o nivel enerxético
• l é o número cuántico secundario ou acimutal e toma valores dende 0, 1,2,3 ... ata (n-1)
Representa a forma dos orbitais atómicos e en átomos polielectrónicos os subniveis de
enerxía que hai nun nivel enerxético n.
Valor de l 0 1 2 3
Tipo orbital atómico s p d f
• m é o número cuántico magnético e toma valores dende -l.....pasando por 0......ata +l
Representa as posibles orientacións espaciais dos orbitais atómicos (OA dexenerados:
mesma enerxía e diferente orientación espacial)
• s é o número cuántico de espín (ou spín) e toma valores de +1/2 ou -1/2
Representa o sentido de xiro do electrón sobre si mesmo en (antihorario ou horario)
Tendo en conta isto resolvo a cuestión:
Para (2,0,0,-1/2)
n=2 polo que l pode valer 0 e 1; se l=0 m so pode tomar o valor de 0 (unha soa posible orientación
espacial) polo que é posible m=0 pero e o número cuántico de spín dos electróns neste orbital atómico pode
valer +1/2 ou -1/2.
Polo que esta combinación de números cuánticos son posibles para un electrón no átomo.
(DEFINEN A UN ELECTRÓN POSIBLE DO ÁTOMO)
Para ( 3,1,-2,1/2)
n=3 polo que l pode valer 0, 1 e 2; se l=1 m pode tomar valores de -1, 0, 1 polo que non é posible m=-
2; o número cuántico de spín pode valer +1/2 ou -1/2.
Polo que esta combinación de números cuánticos non son posibles para un electrón no átomo.
(NON DEFINEN A NINGÚN ELECTRÓN POSIBLE DO ÁTOMO)
1.1) Se algunha combinación é posible describe e debuxa orbital atómico no que se sitúa o
electrón.
A combinación posible é (2,0,0,-1/2) onde o electrón se atopa no orbital atómico con n=2 ( segundo nivel
electrónico); l=0 ortibal atómico tipo s; m=0 cunha soa posible orientación espacial. Atópase no orbital 2s
Este orbital é un orbital esférico.
You might also like
- ABAUB2 Atomos GLDocument11 pagesABAUB2 Atomos GLMaria Rey RicoNo ratings yet
- Tema6 ColorDocument48 pagesTema6 ColorHugo BlancoNo ratings yet
- Exames09 10Document6 pagesExames09 10Lucía Paniagua GonzálezNo ratings yet
- CorralSertal Javier Pract 1Document9 pagesCorralSertal Javier Pract 1nuriaaaa1010No ratings yet
- ABAU - 2018 - Fisica (2021 - 11 - 16 13 - 14 - 25 UTC)Document13 pagesABAU - 2018 - Fisica (2021 - 11 - 16 13 - 14 - 25 UTC)MarioNo ratings yet
- Examen de Selectividad 2020 23 - FISICADocument2 pagesExamen de Selectividad 2020 23 - FISICASonia González UzNo ratings yet
- 2022 - 09 - Preguntas Abau Ud1Document1 page2022 - 09 - Preguntas Abau Ud1JOSE MARTINNo ratings yet
- 005 Réxime Estacionario SinusoidalDocument1 page005 Réxime Estacionario SinusoidalMelanie García GonzálezNo ratings yet
- Ondas Eletromagnéticas PDFDocument25 pagesOndas Eletromagnéticas PDFCarlos HenriqueNo ratings yet
- 7.-23 Fisica 2021Document2 pages7.-23 Fisica 2021AdriánNo ratings yet
- Problemas Selectividade ResoltosDocument16 pagesProblemas Selectividade ResoltosLaura GomezNo ratings yet
- ABAU - 2020 - Fisica - 23 (2021 - 11 - 16 13 - 14 - 25 UTC)Document8 pagesABAU - 2020 - Fisica - 23 (2021 - 11 - 16 13 - 14 - 25 UTC)MarioNo ratings yet
- 2º Bach F T02 Campo EléctricoDocument4 pages2º Bach F T02 Campo EléctricoManuel González QuirogaNo ratings yet
- PAU 2016 FisicaDocument10 pagesPAU 2016 FisicaacademiascioNo ratings yet
- Segunda Proba 09 11 2017Document5 pagesSegunda Proba 09 11 2017Kika EsNo ratings yet
- Tema 2 ElectroDocument25 pagesTema 2 ElectroClara EfeNo ratings yet
- EJERC - CONFIGURACIÓN ELECTRÓNICA-REpAsODocument2 pagesEJERC - CONFIGURACIÓN ELECTRÓNICA-REpAsOLucero Fernanda Vera ArrateaNo ratings yet
- 01 Tema5 Parte1Document32 pages01 Tema5 Parte1claudiagNo ratings yet
- Electromagnetismo CIUGDocument20 pagesElectromagnetismo CIUGManuel Casanova DiazNo ratings yet
- 23 FisicaDocument9 pages23 FisicapedromrochamNo ratings yet
- Átomos E Partículas Subatómicas: Ión Positivo Ou Catión. Ou AniónDocument3 pagesÁtomos E Partículas Subatómicas: Ión Positivo Ou Catión. Ou AniónEmilio VeirasNo ratings yet
- 24 QuimicaDocument13 pages24 Quimicasalpablo41No ratings yet
- Diapos4 2223Document18 pagesDiapos4 2223llagocondeNo ratings yet
- Apuntamentos Electricidade e MagnetismoDocument10 pagesApuntamentos Electricidade e MagnetismoantonpascuallageNo ratings yet
- FQE-10 Sensores - GalDocument19 pagesFQE-10 Sensores - GalLuisNo ratings yet
- Para Preparar Examen ElectromagnetismoDocument2 pagesPara Preparar Examen ElectromagnetismoMarcelino José Veiguela FuentesNo ratings yet
- O Método Do Lugar Das Raízes - 2005Document7 pagesO Método Do Lugar Das Raízes - 2005Eduardo Abuhamad PetrocinoNo ratings yet
- Ejercicios y Cuestiones ResueltasDocument40 pagesEjercicios y Cuestiones Resueltasjaimemuino09No ratings yet
- EJERCICIOS MAGNETISMO (Exámenes PAU)Document3 pagesEJERCICIOS MAGNETISMO (Exámenes PAU)MartaNo ratings yet
- B6 Fisica XXABAUGalDocument30 pagesB6 Fisica XXABAUGalNatalia Sanchiño AnteloNo ratings yet
- Boletín Tema 8-9 - AstronomíaDocument2 pagesBoletín Tema 8-9 - AstronomíapedroNo ratings yet
- Quím A.B.A.U. 2012Document12 pagesQuím A.B.A.U. 2012Mencía CambreNo ratings yet
- FQE-1 Teoria Atomica e Enlace - GalDocument39 pagesFQE-1 Teoria Atomica e Enlace - GalLuisNo ratings yet
- 01 Tema2 O Poliedro de CoordinacionDocument45 pages01 Tema2 O Poliedro de CoordinacionclaudiagNo ratings yet
- Tema 1 Radiación e Ondas FfeDocument38 pagesTema 1 Radiación e Ondas FfeVera Lorenzo RNo ratings yet
- 01 Tema3 Parte3Document24 pages01 Tema3 Parte3Celeste FernandezNo ratings yet
- 01 Tema3 Parte1Document15 pages01 Tema3 Parte1claudiagNo ratings yet
- Electrostatica 2Document2 pagesElectrostatica 2Amelia RodriguezNo ratings yet
- Segundo Deber 2016BDocument2 pagesSegundo Deber 2016BElizabeth JLNo ratings yet
- OndasDocument20 pagesOndasMr ADCNo ratings yet
- A5 DiagonalizacionDocument10 pagesA5 DiagonalizacionMaydayNo ratings yet
- Enlace Quimico y Propiedades de Las SustanciasDocument7 pagesEnlace Quimico y Propiedades de Las Sustanciasmaica jggbNo ratings yet
- L1 Indice de RefraccionDocument5 pagesL1 Indice de RefraccionFran VegaNo ratings yet
- Enunciados CineticasDocument8 pagesEnunciados Cineticasgemmavecino18No ratings yet
- Matematicas IIIDocument185 pagesMatematicas IIIMacbookaluNo ratings yet
- Recuperacion 2º AvaliacionDocument1 pageRecuperacion 2º AvaliacionXenxo Pérez GarcíaNo ratings yet
- 24 Quimica OrdDocument5 pages24 Quimica OrdT. María SuárezNo ratings yet
- P1 F4 2023 2 VF GABADocument18 pagesP1 F4 2023 2 VF GABAjgato906No ratings yet
- Traballo Veran 2013 Fisica2bacDocument70 pagesTraballo Veran 2013 Fisica2bacXerman Prieto DezaNo ratings yet
- 01 Tema4Document23 pages01 Tema4claudiagNo ratings yet
- Enlace Quimic0 PDFDocument39 pagesEnlace Quimic0 PDFhumanNo ratings yet
- Tecnologia de Concretos Practica 4.1Document16 pagesTecnologia de Concretos Practica 4.1Ferddy Perdomo100% (1)
- Cuestiones ElectromagnetismoDocument6 pagesCuestiones ElectromagnetismoA Liz Marjorie T. TineoNo ratings yet
- B4 Ondas PAUGalDocument34 pagesB4 Ondas PAUGalLiliNo ratings yet
- Modelo Exame QuímicaDocument1 pageModelo Exame Químicaja jeNo ratings yet
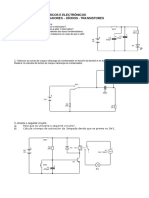
- Ud-4: Sistemas Eléctricos E Electrónicos Boletín Nº3: Condensadores - Díodos - TransistoresDocument3 pagesUd-4: Sistemas Eléctricos E Electrónicos Boletín Nº3: Condensadores - Díodos - TransistoresJ.P. 21No ratings yet
- Exame Xaneiro 2023 - January 2023 ExamDocument4 pagesExame Xaneiro 2023 - January 2023 Examyong chenNo ratings yet