Professional Documents
Culture Documents
المعايرة
المعايرة
Uploaded by
benyamina imaneCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
المعايرة
المعايرة
Uploaded by
benyamina imaneCopyright:
Available Formats
المدرسة العليا لألساتذة مستغانم /قسم العلوم الدقيقة
2022.2021
عمل تطبيقي رقم " :3معايرة حمض أساس"
الهدف:
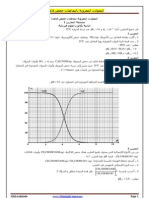
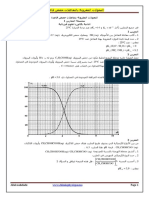
الهدف من المعايرة هو التعرف على تركيز مجهول لمحلول ما :إما عن طريق استعمال الكاشف الملون أو برسم
منحنى تغير pHبواسطة محلول السحاحة المسكوب.
في هذا العمل سوف نستعمل الطريقة االولى لمعرفة تركيز محلول األحماض.
الكاشف الملون :Indicateur Coloré .I
هو حمض ضعيف أو أساس ضعيف (عضوي) يتغير لونه بتغير ال .pH
الكاشف الملون لون الوسط الحامضي لون الوسط القاعدي مجال تغير اللون pH
أزرق البروموتيمول أصفر أورق 7,6 – 6
فينول فتاليين عديم اللون وردي 8,2-10
خطوات العمل: .II
حضر السحاحة وامألها هيدروكسيد الصوديوم « » NaOHنظاميته .0,5N .1
قم بأخذ 10mlمن محلول مجهول التركيز باالستعانة بماصة مناسبة وضعه في دورق زجاجي. .2
أضف بعض القطرات من الكاشف الملون. .3
ابدأ المعايرة بفتح صمام السحاحة بتمهل (قطرة قطرة). .4
عند تغير اللون ،اغلق صمام السحاحة و سجل الحجم المسكوب. .5
أعد التجربة ثالث مرات. .6
األسئلة: .III
ضع رسم توضيحي للتجربة .1
أكتب المعادلتين النصفيتين والمعادلة االجمالية للتفاعل الكيميائي .2
أحسب تركيز المحاليل عند نقطة التكافؤ. .3
أحسب :pHاألحماض و هيدروكسيد الصوديوم و الخليط عند نقطة التكافؤ. .4
ما هو الفرق بين األحماض و كيف يمكن تفسير هذا االختالف. .5
اذا علمت أن حمض االيثانويك « » CH3COOHهو حمض ضعيف و األمونياك « » NH4OHهو .6
أساس ضعيف تركيز كل منهما هو .M 0,1احسب pHالمحلولين .يعطى:
Kb« NH4OH »= 1,8 10-5 pKa« CH3COOH »= 4,75
You might also like
- معايرة حمض أساس TP3Document1 pageمعايرة حمض أساس TP3benyamina imaneNo ratings yet
- العمل التطبيقي رقم 3Document2 pagesالعمل التطبيقي رقم 3amdjedtouka84No ratings yet
- طرق التحليل الحجميDocument4 pagesطرق التحليل الحجميAhmed Khotcho100% (1)
- Ex Regul AsservDocument4 pagesEx Regul AsservZahk LbatlNo ratings yet
- كواشف الاحماض و القلوياتDocument2 pagesكواشف الاحماض و القلوياتAbdelmoumenAbdelmoumenNo ratings yet
- وحدة 4 سلسلة نهائيةDocument2 pagesوحدة 4 سلسلة نهائيةHassouNo ratings yet
- 6 2Document5 pages6 2Brsioft BloggerNo ratings yet
- كيمياء تحليلية عملي 1Document15 pagesكيمياء تحليلية عملي 1Sajad JasimNo ratings yet
- Pubdoc 10 20734 1405Document3 pagesPubdoc 10 20734 1405محمد العراقيNo ratings yet
- تفاعلات بعض المواد مع المحاليلDocument6 pagesتفاعلات بعض المواد مع المحاليلReddahi BrahimNo ratings yet
- مراجعةDocument5 pagesمراجعةbouchireb smiaNo ratings yet
- كيمياء عامة PDFDocument68 pagesكيمياء عامة PDFKhaled HamidiNo ratings yet
- Dzexams Docs 3as 904821Document2 pagesDzexams Docs 3as 904821ặděɱ ɱěžĥŏud-أدمہ مہزهودNo ratings yet
- لقطة شاشة 2023-02-16 في 1.37.26 صDocument14 pagesلقطة شاشة 2023-02-16 في 1.37.26 صmizare29gNo ratings yet
- UntitledDocument13 pagesUntitledرضا محسن عبداللهNo ratings yet
- Exercices Acide Base Serie 1 Et Serie 2Document9 pagesExercices Acide Base Serie 1 Et Serie 2keomatNo ratings yet
- المشعرات الكيميائيةDocument16 pagesالمشعرات الكيميائيةSara M AmeenNo ratings yet
- Pubdoc 10 12128 1405Document2 pagesPubdoc 10 12128 1405sciencelab2023No ratings yet
- Nouveau Microsoft Word DocumentDocument7 pagesNouveau Microsoft Word DocumentbsbsjsjdhNo ratings yet
- مقدمة علی المعايرة (titration)Document4 pagesمقدمة علی المعايرة (titration)Amros AtuirNo ratings yet
- 17-المحاليل الحمضية والمحاليل القاعديةDocument19 pages17-المحاليل الحمضية والمحاليل القاعديةghzialeNo ratings yet
- Dzexams Docs 3as 904821Document3 pagesDzexams Docs 3as 904821wwaassiim2006No ratings yet
- تعيين كمية المادة بواسطة المعايرة ش.رDocument12 pagesتعيين كمية المادة بواسطة المعايرة ش.رilyesmsegeumNo ratings yet
- Bac 2010 SCDocument1 pageBac 2010 SCmehdibsbtNo ratings yet
- 2 - Evolution Dun Systeme Vers Un Etat DequilibreDocument62 pages2 - Evolution Dun Systeme Vers Un Etat Dequilibrezybras100% (2)
- التحولات الكيميائية التي تحدث في المنحيينDocument3 pagesالتحولات الكيميائية التي تحدث في المنحيينOmar ait taleb aliNo ratings yet
- 3 Ste 2012Document3 pages3 Ste 2012Soukrani AbdeljabbarNo ratings yet
- المعايرة الحمضية القاعديةDocument4 pagesالمعايرة الحمضية القاعديةالغزيزال الحسن EL GHZIZAL Hassane100% (13)
- PH المحاليلDocument2 pagesPH المحاليلsaid kabbachNo ratings yet
- 05- المحاليل الحمضية و المحاليل القاعدية (Www.pc1.Ma)Document2 pages05- المحاليل الحمضية و المحاليل القاعدية (Www.pc1.Ma)Abdo ElNo ratings yet
- تمارين المعايرات المباشرة أولى باك النموذج 1 PDFDocument12 pagesتمارين المعايرات المباشرة أولى باك النموذج 1 PDFAyoub FatheNo ratings yet
- ةوق Hcl .Na₂Co₃Document3 pagesةوق Hcl .Na₂Co₃Maoth AhmedNo ratings yet
- بحث تعيين قياس الأس الهيدروجينDocument11 pagesبحث تعيين قياس الأس الهيدروجينم.احمد سالمNo ratings yet
- EDUSJ - Volume 26 - Issue 5 - Pages 197-209Document13 pagesEDUSJ - Volume 26 - Issue 5 - Pages 197-209foaad foaadNo ratings yet
- تعين الرقم الهيدرجونيDocument12 pagesتعين الرقم الهيدرجونيamdaNo ratings yet
- Exercice 1 Chimie Dars 3 Et 4Document1 pageExercice 1 Chimie Dars 3 Et 4كل المواضيعNo ratings yet
- الجلسة العملية الثالثةDocument5 pagesالجلسة العملية الثالثةRyam DhamNo ratings yet
- التحولات الكيميائية التي تحدث في منحيينDocument7 pagesالتحولات الكيميائية التي تحدث في منحيينEl Youbi MohammedNo ratings yet
- تمارين تطبيقية للتفاعلات الحمضية القاعديةDocument1 pageتمارين تطبيقية للتفاعلات الحمضية القاعديةfalkosatNo ratings yet
- Benzoic AcidDocument8 pagesBenzoic AcidIN BOLD بالخط العريضNo ratings yet
- تقدير تركيز هيدروكسيد الصوديوم بالمعايرة في الحامضDocument5 pagesتقدير تركيز هيدروكسيد الصوديوم بالمعايرة في الحامضNAINo ratings yet
- Exc3b 2bac PDFDocument2 pagesExc3b 2bac PDFAbdelmoghit IdhsaineNo ratings yet
- التقارير المخبرية لمقرر الكيمياء 4Document3 pagesالتقارير المخبرية لمقرر الكيمياء 4مها طهيفNo ratings yet
- الموضوع الثاني..Document6 pagesالموضوع الثاني..Bedani DjilaliNo ratings yet
- Exercices de Chimie Transformation Chimique S'effectuant Dans Les Deux Sens TPC SM Classe 10Document3 pagesExercices de Chimie Transformation Chimique S'effectuant Dans Les Deux Sens TPC SM Classe 10keomatNo ratings yet
- العمل التطبيقي الثالثDocument4 pagesالعمل التطبيقي الثالثNAZIRONo ratings yet
- Semiconductor MaterialsDocument4 pagesSemiconductor Materialsshahadhaider902No ratings yet
- Wa0032.Document41 pagesWa0032.نعمة حسنNo ratings yet
- 12 2019 01 25!12 05 43 AmDocument17 pages12 2019 01 25!12 05 43 AmbasheeralajolNo ratings yet
- UntitledDocument21 pagesUntitledmohamed yacineNo ratings yet
- Final: Chemistry Lab 107 .موتع ي فاص انلا:دادعإDocument57 pagesFinal: Chemistry Lab 107 .موتع ي فاص انلا:دادعإchemistry tutorialNo ratings yet
- عباس محمد بوهان تقرير مختبر التحليل الآليDocument10 pagesعباس محمد بوهان تقرير مختبر التحليل الآليabbas mohammedNo ratings yet
- عباس محمد بوهان تقرير مختبر التحليل الآليDocument10 pagesعباس محمد بوهان تقرير مختبر التحليل الآليabbas mohammedNo ratings yet
- Exercices Acide Base Serie 1 Et Serie 2Document9 pagesExercices Acide Base Serie 1 Et Serie 2jackNo ratings yet
- مقياس الرقم الهيدروجينيPHDocument4 pagesمقياس الرقم الهيدروجينيPHmohamed hassanNo ratings yet
- مجبل4Document5 pagesمجبل4yahyaalmoalmNo ratings yet
- Serie Chim 1Document2 pagesSerie Chim 1Ouarid NassiraNo ratings yet
- سلسلة تمارين توليفية رقم 2 السنة الثالثة إعدادي السنة الدراسية 2012 2013 من إعداد الأستاذ يونس مقرينيDocument2 pagesسلسلة تمارين توليفية رقم 2 السنة الثالثة إعدادي السنة الدراسية 2012 2013 من إعداد الأستاذ يونس مقرينيYoussef JakeNo ratings yet