Professional Documents
Culture Documents
05- المحاليل الحمضية و المحاليل القاعدية (Www.pc1.Ma)
Uploaded by
Abdo ElCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
05- المحاليل الحمضية و المحاليل القاعدية (Www.pc1.Ma)
Uploaded by
Abdo ElCopyright:
Available Formats
العلوم الفيزيائية السنة الثالثة ثانوي إعدادي ذ .
عبد الخالق البهجة
المحاليل الحمضية و المحاليل القاعدية
Solutions acides et solutions basiques
مفهوم pHو قياسه )1
)1-1المحلول المائي
المحلول المائي خليط متجانس نحصل عليه بإذابة جسم صلب أو سائل أو غازي في الماء.
أمثلة :محلول الملح؛ محلول حمض الكلوريدريك؛ محلول الصودا.....
pH )1-2محلول مائي
pHمحلول مائي هو عدد بدون وحدة محصور بين 0و 14يميز حموضة أو قاعدية محلول مائي.
يقاس pHمحلول مائي بواسطة ورق pHأو جهاز -pHمتر.
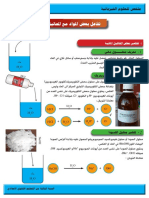
)1-3ورق pH
ورق pHورق مشبع بمادة تأخذ ألوان مختلفة عند تبليلها بمحاليل مائية مختلفة Q،وكل لون يقابله عدد
على علبة ورق pHيحدد قيمة pHالمحلول المائي.
تصنيف المحاليل المائية )2
تــجــربــة:
نقوم بقياس pHمحاليل مائية مختلفة باستعمال ورق pHونسجل النتائج في الجدول التالي:
ماء محلول محلول ماء عصير حمض
المحاليل
جافيل الصودا الملح مقطر الليمـون الكلوريدريك
قيمة pH
للمحاليل المائية قيم pHمختلفة ( .) pH>7 , pH=7 , pH<7
اسـتـنـتـاج:
تصنف المحاليل المائية إلى ثالثة أصناف:
-محاليل ذات :pH<7تسمى محاليل حمضية؛
-محاليل ذات :pH=7تسمى محاليل محايدة؛
-محاليل ذات :pH>7تسمى محاليل قاعدية؛
تمكن قيمة pHمن ترتيب المحاليل الحمضية فيما بينها و المحاليل القاعدية فيما بينها.
المحاليل Qالمائية و األيونات +Hو -OH )3
يحتوي الماء و جميع المحاليل المائية على أيونات الهيدروجين Hو الهيدروكسيد : OH
- +
-المحاليل المحايدة :تحتوي على نفس العدد من األيونات +Hو -OH؛
العلوم الفيزيائية السنة الثالثة ثانوي إعدادي ذ .عبد الخالق البهجة
-المحاليل الحمضية :يكون فيها عدد األيونات +Hأكبر من عدد األيونات -OH؛
-المحاليل القاعدية :يكون فيها عدد األيونات -OHأكبر من عدد األيونات +H؛
تخفيف المحاليل Qالحمضية Qو القاعديةQ )4
تــجــربــة:
نقوم بقياس pHحمض الكلوريدريك و محلول الصودا قبل و بعد عملية التخفيف ،ونسجل النتائج في
الجدول التالي:
pHبعد pHبعد pHقبل
مالحظات نوعه المحلول المائي
التخفيف الثاني التخفيف األول التخفيف
حمض الكلوريدريك
محلول الصودا
اسـتـنـتـاج:
-تتم عملية التخفيف بإضافة المحلول الحمضي أو القاعدي إلى الماء الخالص ،و تمكن من الحصول على
محاليل أقل حمضية أو أقل قاعدية.
-تزداد قيمة pHعند تخفيف محلول حمضي ( دون أن تتجاوز .) 7
-تتناقص قيمة pHعند تخفيف محلول قاعدي ( دون أن تنزل عن .) 7
-تمكن عملية التخفيف من الحد من خطورة المحاليل الحمضية و المحاليل القاعدية المركزة.
أخطار المحاليل الحمضية و القاعدية )5
نستعمل في حياتنا اليومية كثيرا من المواد الكيميائية كمحلول حمض الكلوريدريك و محلول الصودا و مواد
أخرى مثل ماء جافيل و الماء األوكسجيني لما تتميز به هذه المواد من خواص مطهرة و منظفة و معقمة..
إال أن سوء استعمال هذه المواد قد يشكل خطر على صحة اإلنسان وسالمة البيئة.
لحماية اإلنسان من أخطار هذه المواد تحمل معلباتها ملصقات وصفية تتضمن معلومات تساعد على
االستعمال اآلمن لهذه المواد مثل:
-اسم المنتوج و الغرض من استعماله.
-العالمات التحذيرية :هي عالمات متعارف عليها دوليا تشير إلى نوعية خطورة المنتوج على الصحة و
البيئة.
-أخطار المنتوج :هي نوعية التأثيرات التي يمكن أن يتسبب فيها هذا المنتوج مثل التسمم و الحروق.
-احتياطات السالمة :هي االحتياطات التي يجب اتخاذها الستعمال المنتوج بكل أمان.
بعض االحتياطات Qالوقائية أثناء استعمال المحاليل الحمضية Qو القاعدية:
يمنع لمس المحاليل الحمضية أو القاعدية باليد. -
يمنع تذوق أو استنشاق المحاليل الحمضية أو القاعدية. -
يمنع إضافة الماء إلى الحمض لتفادي تطاير قطرات الحمض. -
يجب تهوية مكان استعمال هذه المحاليل. -
يجب تخفيف المحاليل المركزة قبل استعمالها. -
يمنع خلط محاليل حمضية أو قاعدية غير معروفة..... . -
You might also like
- صيانة المسابحDocument46 pagesصيانة المسابحOussama MenoukateNo ratings yet
- تصنيع الأغذية - الجزء العمليDocument78 pagesتصنيع الأغذية - الجزء العمليahmida81100% (1)
- PH المحاليلDocument2 pagesPH المحاليلsaid kabbachNo ratings yet
- تفاعلات بعض المواد مع المحاليلDocument6 pagesتفاعلات بعض المواد مع المحاليلReddahi BrahimNo ratings yet
- Tfaalat Badh Almoad Ma Almhalil Alhmdhia Oalqaadia Mlkhs Aldrs 2Document3 pagesTfaalat Badh Almoad Ma Almhalil Alhmdhia Oalqaadia Mlkhs Aldrs 2EL ATTAOUI Oubaid100% (1)
- العمل التطبيقي رقم 3Document2 pagesالعمل التطبيقي رقم 3amdjedtouka84No ratings yet
- 05المحاليل الحمضية والمحاليل القاعديةDocument3 pages05المحاليل الحمضية والمحاليل القاعديةrashaNo ratings yet
- 05المحاليل الحمضية والمحاليل القاعديةDocument3 pages05المحاليل الحمضية والمحاليل القاعديةrashaNo ratings yet
- 2 - Evolution Dun Systeme Vers Un Etat DequilibreDocument62 pages2 - Evolution Dun Systeme Vers Un Etat Dequilibrezybras100% (2)
- همظنملا ليلاحملا Buffer SolutionsDocument33 pagesهمظنملا ليلاحملا Buffer SolutionsjngpgsgqrnNo ratings yet
- Nouveau Microsoft Word DocumentDocument7 pagesNouveau Microsoft Word DocumentbsbsjsjdhNo ratings yet
- 17-المحاليل الحمضية والمحاليل القاعديةDocument19 pages17-المحاليل الحمضية والمحاليل القاعديةghzialeNo ratings yet
- مقياس الرقم الهيدروجينيPHDocument4 pagesمقياس الرقم الهيدروجينيPHmohamed hassanNo ratings yet
- نسخة عرض تقديمي (3) Document12 pagesنسخة عرض تقديمي (3) wnkvwgxvkrNo ratings yet
- سلسلة تمارين توليفية رقم 2 السنة الثالثة إعدادي السنة الدراسية 2012 2013 من إعداد الأستاذ يونس مقرينيDocument2 pagesسلسلة تمارين توليفية رقم 2 السنة الثالثة إعدادي السنة الدراسية 2012 2013 من إعداد الأستاذ يونس مقرينيYoussef JakeNo ratings yet
- سلسلة تمارين توليفية رقم 2 السنة الثالثة إعدادي السنة الدراسية 2012 2013 من إعداد الأستاذ يونس مقريني - 2Document2 pagesسلسلة تمارين توليفية رقم 2 السنة الثالثة إعدادي السنة الدراسية 2012 2013 من إعداد الأستاذ يونس مقريني - 2Youssef JakeNo ratings yet
- UntitledDocument13 pagesUntitledرضا محسن عبداللهNo ratings yet
- ترجمه كيمياء عملي المحاضره الثالثهDocument11 pagesترجمه كيمياء عملي المحاضره الثالثهمنوعاتNo ratings yet
- Dzexams Docs 3as 904821Document2 pagesDzexams Docs 3as 904821ặděɱ ɱěžĥŏud-أدمہ مہزهودNo ratings yet
- تعين الرقم الهيدرجونيDocument12 pagesتعين الرقم الهيدرجونيamdaNo ratings yet
- الجلسة 9Document2 pagesالجلسة 9TahaniNo ratings yet
- 12 2017 10 01!07 29 45 PMDocument25 pages12 2017 10 01!07 29 45 PMhoudahmdoudaNo ratings yet
- بحث تعيين قياس الأس الهيدروجينDocument11 pagesبحث تعيين قياس الأس الهيدروجينم.احمد سالمNo ratings yet
- تطور جملة كيميائية نحو حالة التوازنDocument28 pagesتطور جملة كيميائية نحو حالة التوازن3adiloNo ratings yet
- التفاعل بين المحاليل الحمضية الحمضية و المحاليل الأساسيةDocument9 pagesالتفاعل بين المحاليل الحمضية الحمضية و المحاليل الأساسيةChahine OffNo ratings yet
- الجلسة 10Document2 pagesالجلسة 10TahaniNo ratings yet
- سلسلة المعايرةDocument3 pagesسلسلة المعايرةالغزيزال الحسن EL GHZIZAL HassaneNo ratings yet
- وحدة 4 سلسلة نهائيةDocument2 pagesوحدة 4 سلسلة نهائيةHassouNo ratings yet
- Dzexams Docs 3as 904821Document3 pagesDzexams Docs 3as 904821wwaassiim2006No ratings yet
- في الاحماض والقواعد 2Document39 pagesفي الاحماض والقواعد 2رهف موسىNo ratings yet
- D8a7d984d982d988d8a7d8b9d8af 2020 1Document197 pagesD8a7d984d982d988d8a7d8b9d8af 2020 1jaafarmousa38No ratings yet
- Pubdoc 10 12128 1405Document2 pagesPubdoc 10 12128 1405sciencelab2023No ratings yet
- وصف الأحماض والقواعدDocument27 pagesوصف الأحماض والقواعدmohammed995595No ratings yet
- التحولات الكيميائية التي تحدث في المنحيينDocument3 pagesالتحولات الكيميائية التي تحدث في المنحيينOmar ait taleb aliNo ratings yet
- عباس محمد بوهان تقرير مختبر التحليل الآليDocument10 pagesعباس محمد بوهان تقرير مختبر التحليل الآليabbas mohammedNo ratings yet
- عباس محمد بوهان تقرير مختبر التحليل الآليDocument10 pagesعباس محمد بوهان تقرير مختبر التحليل الآليabbas mohammedNo ratings yet
- تمارين تطبيقية للتفاعلات الحمضية القاعديةDocument1 pageتمارين تطبيقية للتفاعلات الحمضية القاعديةfalkosatNo ratings yet
- التحولات الكيميائية التي تحدث في منحيينDocument7 pagesالتحولات الكيميائية التي تحدث في منحيينEl Youbi MohammedNo ratings yet
- C3-التحولات التي تحدث في المنحيين PDFDocument7 pagesC3-التحولات التي تحدث في المنحيين PDFHarakat ElhoucineNo ratings yet
- تحديد الكافيئين وحمض البنزويك في المشروبات الغازيةDocument3 pagesتحديد الكافيئين وحمض البنزويك في المشروبات الغازيةMoradoo MorNo ratings yet
- Ex Regul AsservDocument4 pagesEx Regul AsservZahk LbatlNo ratings yet
- DAHEL MT - Lycée Benalioui Salah SETIFDocument7 pagesDAHEL MT - Lycée Benalioui Salah SETIFSarl IBN ROCHDNo ratings yet
- G12A Sem2 Unit5 الدرس الثالثDocument22 pagesG12A Sem2 Unit5 الدرس الثالثmr MeetNo ratings yet
- 1 3Document28 pages1 3omar bergelehNo ratings yet
- Altholat Alkimiaiia Alti THDTH Fi Mnhiin Mlkhs Aldrs 3 PDFDocument3 pagesAltholat Alkimiaiia Alti THDTH Fi Mnhiin Mlkhs Aldrs 3 PDFmemez phosphateNo ratings yet
- مقدمة في الاحماض والقواعدDocument59 pagesمقدمة في الاحماض والقواعدHossam SaadNo ratings yet
- Pubdoc 10 20734 1405Document3 pagesPubdoc 10 20734 1405محمد العراقيNo ratings yet
- Local Media1736541324Document18 pagesLocal Media1736541324benhamdiadil24No ratings yet
- Publication 3 27706 350Document57 pagesPublication 3 27706 350Elsayed ElazazyNo ratings yet
- UntitledDocument72 pagesUntitledمحمد طاهرNo ratings yet
- طرق التحليل الحجميDocument4 pagesطرق التحليل الحجميAhmed Khotcho100% (1)
- لقطة شاشة 2023-02-16 في 1.37.26 صDocument14 pagesلقطة شاشة 2023-02-16 في 1.37.26 صmizare29gNo ratings yet
- تقدير تركيز هيدروكسيد الصوديوم بالمعايرة في الحامضDocument5 pagesتقدير تركيز هيدروكسيد الصوديوم بالمعايرة في الحامضNAINo ratings yet
- Exercices Acide Base Serie 1 Et Serie 2Document9 pagesExercices Acide Base Serie 1 Et Serie 2keomatNo ratings yet
- كواشف الاحماض و القلوياتDocument2 pagesكواشف الاحماض و القلوياتAbdelmoumenAbdelmoumenNo ratings yet
- الموضوع الثاني..Document6 pagesالموضوع الثاني..Bedani DjilaliNo ratings yet
- Anesthesia & Extraction 07Document20 pagesAnesthesia & Extraction 07mohammedhs905No ratings yet
- فرض 2 د-2 الاولى العلوم الفيزياءDocument1 pageفرض 2 د-2 الاولى العلوم الفيزياءAbdo ElNo ratings yet
- فرض2الاسدس1الاولىDocument1 pageفرض2الاسدس1الاولىAbdo ElNo ratings yet
- جدادةالفرض2الاولىDocument1 pageجدادةالفرض2الاولىAbdo ElNo ratings yet
- فرض 2 فيزياءDocument2 pagesفرض 2 فيزياءAbdo ElNo ratings yet
- جدادة فرض2 اس1 الأولى2012-2013Document1 pageجدادة فرض2 اس1 الأولى2012-2013Abdo ElNo ratings yet
- 13-إختبار المكتسبات القبليةDocument4 pages13-إختبار المكتسبات القبليةAbdo ElNo ratings yet
- التوزيع المجالي للوحدة اولى عالم الأصدقاء المستوى الثالث ابتدائيDocument3 pagesالتوزيع المجالي للوحدة اولى عالم الأصدقاء المستوى الثالث ابتدائيAbdo ElNo ratings yet
- - ملخصات دروس النشاط العلمي للمستوى السادس - نموذج 2Document3 pages- ملخصات دروس النشاط العلمي للمستوى السادس - نموذج 2Abdo ElNo ratings yet
- 3Document2 pages3Abdo ElNo ratings yet
- ملخصات الشاملة النشاط العلمي المنهاج المنقح 2020 السادس ابتدائيDocument14 pagesملخصات الشاملة النشاط العلمي المنهاج المنقح 2020 السادس ابتدائيAbdo El100% (1)
- التوزيع المجالي للوحدة اولى عالم الأصدقاء المستوى الثالث ابتدائيDocument3 pagesالتوزيع المجالي للوحدة اولى عالم الأصدقاء المستوى الثالث ابتدائيAbdo ElNo ratings yet
- الحكاية 1و 2 و 3Document4 pagesالحكاية 1و 2 و 3Abdo ElNo ratings yet