Professional Documents
Culture Documents
Các phương trình Phân NPK
Uploaded by
Tài Minh0 ratings0% found this document useful (0 votes)
3 views4 pagesCopyright
© © All Rights Reserved
Available Formats
DOCX, PDF, TXT or read online from Scribd
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
© All Rights Reserved
Available Formats
Download as DOCX, PDF, TXT or read online from Scribd
0 ratings0% found this document useful (0 votes)
3 views4 pagesCác phương trình Phân NPK
Uploaded by
Tài MinhCopyright:
© All Rights Reserved
Available Formats
Download as DOCX, PDF, TXT or read online from Scribd
You are on page 1of 4
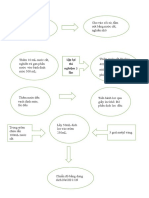
Phương pháp hấp phụ NH3 bằng H2SO4
Protid + H2SO4đđ/xt (NH4)2SO4 + NaOH% NH3
NH3 + H2SO4 dư (NH4)2SO4
H2SO4 + NaOH Na2SO4 + H2O
NH3 được hấp phụ vào dung dịch chuẩn H2SO4 dư chính xác, sau khi chưng cất lôi
cuốn hơi nước hết NH3, chuẩn độ lượng H2SO4 còn lại bằng dung dịch chuẩn
NaOH với chỉ thị thích hợp (pT = 5 5.5).
Phương pháp hấp phụ NH3 bằng H3BO3
Protid + H2SO4đđ/xt (NH4)2SO4 + NaOH% NH3
NH3 + H3BO3 NH4H2BO3
H2BO3- + H+ H3BO3
NH3 được hấp phụ vào dung dịch H3BO3 bão hòa. Sau đó dung dịch H2BO3- được
chuẩn bằng dung dịch chuẩn H2SO4 đến pH=5.4 với chỉ thị thích hợp.
H3BO3 là acid rất yếu (Ka = 5,8.10-10), dung dịch H3BO3 bão hòa (0.65M) có
pH=4,7. Khi trung hòa hết 20% H+ bằng NH3 thì pH tăng lên 8.6. Với 25mL dung
dịch có thể tương ứng 48mg N.
Các phương pháp xác định Nitơ dạng amoni
Phương pháp folmaldehyde
Trong môi trường trung tính, NH4+ phản ứng với folmaldehyde tạo thành
hexamethylen tetra amin và acid vô cơ. Dùng dung dịch chuẩn NaOH chuẩn độ
acid tạo thành từ đó xác định được hàm lượng N – NH4+.
2(NH4)2SO4 + 6HCHO = (CH2)6N4 + 2H2SO4 + 6H2O
Các phương pháp xác định phospho
Phương pháp khối lượng
Phương pháp dựa trên việc kết tủa ion phosphat bằng hỗn hợp muối magie (Mg +
NH4+) dưới dạng magie amoni phosphat (NH4MgPO4.6H2O). Nung, cân kết tủa
dạng Mg2P2O7 và tính ra % P2O5 có trong mẫu.
H3PO4 + MgCl2 + 3NH4OH MgNH4PO4 + 2 NH4Cl + 3H2O
Ca(H2PO4)2 + MgCl2 + 4NH4OH MgNH4PO4 + CaCl2 + 2NH4Cl + 4H2O
CaHPO4 + MgCl2 + NH4OH MgNH4PO4 + CaCl2 +H2O
FePO4 +MgCl2 + 3NH4OH MgNH4PO4+ FeCl3 + NH4Cl+H2O
Lọc kết tủa sấy nung:
2 MgNH4PO4 Mg2P2O7 + 2NH3 + H2O
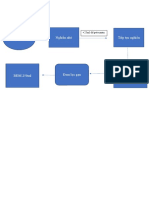
Phương pháp thể tích
Phá mẫu bằng hệ cường thủy, loại bỏ tạp chất không tan và keo Silic, trong dung
dịch chứa ion PO4-. Làm kết tủa ion này dưới dạng kết tủa vàng PhosphoMolipdat
bằng thuốc thử (NH4)2MoO4 trong HNO3 dung dịch nóng.
H3PO4 + 12(NH4)2MoO4 + 21HNO3 21NH4NO3 + (NH4)3H4[P(MoO7)6] +
10H2O
Lọc rửa kết tủa cho sạch axit, rồi hòa tan kết tủa bằng dung dịch kiềm chuẩn NaOH
có dư.
2(NH4)3H4[P(MoO7)6] + 46NaOH 2(NH4)2HPO4 +23Na2MoO4
+(NH4)2MoO4 +26H2O
Rồi chuẩn lại lượng kiềm dư bằng axit tiêu chuẩn HCl, nhận điểm tương đương
bằng chỉ thị PP.
HCl + NaOH NaCl + H2O
Phương pháp trắc quang
Thuốc thử molypdat (dạng phức màu vàng)
Trong môi trường acid, PO43- tạo phức với molypdat hợp chất phức màu vàng.
PO43- + 12MoO42- + 27H+ H3[P(Mo12O40)] + 12H2O
Trong hợp chất phức, tỉ lệ P : Mo có thể là: 1 : 3; 1 : 6; 1 : 9; hoặc 1 : 12. Trong đó
tỉ lệ 1 : 12 là bền nhất và thường dùng trong định lượng.
Hợp chất phức này ở hàm lượng nhỏ, là hợp chất phức màu vàng, hấp thu ở
380nm. Khi hàm lượng phospho lớn, sẽ tạo kết tủa vàng và có thể định lượng bằng
phương pháp thể tích.
Lượng dư thuốc thử ảnh hưởng đến phép đo độ hấp thu ở bước sóng tương tự. Để
giảm ảnh hưởng có thể đo ở bước sóng 400 – 420nm.
Thuốc thử molypdat (dạng phức màu xanh)
Nếu mẫu có nhiều Fe3+ (có màu vàng trong môi trường acid, hấp thu cùng một
bước sóng) ta có thể chuyển phức màu vàng này sang dạng màu xanh. Hợp chất
phức này hấp thu tại 2 bước sóng là 886nm và 720nm.
H3[P(Mo12O40)] + ne- + nH+ H3[P(Mo12O40)Hn]
Màu vàng n=1–4 màu xanh
Tùy theo n ta có thể có các dạng phức khác nhau, trong trường hợp này Mo(VI) bị
khử thành Mo(V) – phức màu xanh.
Phụ thuộc vào chất khử được sử dụng như SnCl2, hydrazin, acid ascorbic, quinon...
mà phức có thành phần khác nhau.
Chất khử yếu với môi trường acid cao là điều kiện thích hợp nhất cho phản ứng,
nên thông thường sử dụng hydrazin hoặc acid ascorbic.
Với acid ascorbic, để tăng tốc độ phản ứng có thể sử dụng thêm
Kaliantimonyltartrat - K(SbOC4H4O).
Với SnCl2, sau khi cho vào cần đo ngay, nếu không cường độ màu sẽ giảm do
SnCl2 là chất khử mạnh.
Thuốc thử molypdovanadat
Ở môi trường acid hợp chất phospho trong dung dịch tạo với molypdovanadat hợp
chất phức màu vàng. Đo mật độ quang của dung dịch tạo thành ở bước sóng 400 –
420 nm. Từ đó tính ra hàm lượng phospho có trong mẫu.
PO43- +2VO43-+10MoO42- + 29H+ H5[P(Mo10V2O40)] + 12H2O
You might also like
- Chương 2-Phan BonDocument43 pagesChương 2-Phan BonMinh Thu Ngo ThiNo ratings yet
- Đề Cương TT Hoá Phân Tích 1Document10 pagesĐề Cương TT Hoá Phân Tích 1Vĩnh ThuầnNo ratings yet
- GluDocument2 pagesGluHUY TRẦN NGUYỄN ANHNo ratings yet
- Báo Cáo TN Hóa Sinh T NG H PDocument44 pagesBáo Cáo TN Hóa Sinh T NG H PLục Thị NgọcNo ratings yet
- ĐỀ CƯƠNG ÔN TẬP KTCLSPTRDocument14 pagesĐỀ CƯƠNG ÔN TẬP KTCLSPTRTiên Tiên LêNo ratings yet
- Bài 5Document6 pagesBài 5Bui Trung Kien B2000343No ratings yet
- (123doc - VN) - BT HPT Chuong 7Document7 pages(123doc - VN) - BT HPT Chuong 7berua203No ratings yet
- CHUẨN ĐỘ OXI HÓA-KHỬDocument2 pagesCHUẨN ĐỘ OXI HÓA-KHỬTiến Cường HoàngNo ratings yet
- Giới ThiệuDocument4 pagesGiới Thiệuming hueNo ratings yet
- Báo Cáo KTCLSPCNDocument4 pagesBáo Cáo KTCLSPCNNguyễn NhưNo ratings yet
- Đề cương thực tậpDocument24 pagesĐề cương thực tậpPhạm Đăng80% (5)
- Báo Cáo TH C Hành Sinh HóaDocument11 pagesBáo Cáo TH C Hành Sinh Hóatam nguyenNo ratings yet
- Báo cáo thí nghiệm bài đường khử tổng sốDocument4 pagesBáo cáo thí nghiệm bài đường khử tổng sốLê Mai LoanNo ratings yet
- Tại sao không thể pha dung dịch KMnO4 có nồng độ định trước theo lượng cân chính xácDocument4 pagesTại sao không thể pha dung dịch KMnO4 có nồng độ định trước theo lượng cân chính xácAnh MaiNo ratings yet
- Bài báo cáo thí nghiệm hóa lí -Bài-1Document5 pagesBài báo cáo thí nghiệm hóa lí -Bài-1Lê ViệtNo ratings yet
- PROTIDDocument34 pagesPROTIDVu JanaNo ratings yet
- Bài 1Document6 pagesBài 1Hien DaoNo ratings yet
- Hoa Phan Tich Dinh Tinh Dai Cuong Cqk4!1!115Document8 pagesHoa Phan Tich Dinh Tinh Dai Cuong Cqk4!1!115anhstan123No ratings yet
- Bài 2Document6 pagesBài 2Bui Trung Kien B2000343No ratings yet
- N I Dung TH C Hành - Bài 5Document4 pagesN I Dung TH C Hành - Bài 5Anh Tuấn Lê NguyễnNo ratings yet
- giáo trình độc chấtDocument23 pagesgiáo trình độc chấtNguyễn Phạm Thái BảoNo ratings yet
- đề cương thi HOÁ PHÂ TÍCHDocument5 pagesđề cương thi HOÁ PHÂ TÍCHLinh PhạmNo ratings yet
- báo cáo thí nghiệm hóa sinh ôn tậpDocument34 pagesbáo cáo thí nghiệm hóa sinh ôn tậpHương KiềuNo ratings yet
- TH HTP1 - CĐOKDocument7 pagesTH HTP1 - CĐOKTuyết NhiNo ratings yet
- BÁO-CÁO-TN-HOÁ-SINH Bài 2Document7 pagesBÁO-CÁO-TN-HOÁ-SINH Bài 2nguyenhuubaspNo ratings yet
- Bài 8 §1. Xác Định Hàm Lượng Mùn Trong Đất Bằng Phương Pháp Chiurin Mở đầuDocument7 pagesBài 8 §1. Xác Định Hàm Lượng Mùn Trong Đất Bằng Phương Pháp Chiurin Mở đầuLong PhạmNo ratings yet
- BÀI P H3PO4 HÔM QUA HỌC BÀI TẬP CHO NGÀY MAIDocument10 pagesBÀI P H3PO4 HÔM QUA HỌC BÀI TẬP CHO NGÀY MAIValerrux RagnvindrNo ratings yet
- GOLD Câu 6 CaoPTDocument4 pagesGOLD Câu 6 CaoPTMINH NGUYỄN NHỰTNo ratings yet
- à N Thi TT Sinh 1Document10 pagesà N Thi TT Sinh 1Ngô Minh NgọcNo ratings yet
- Phantichdiinhluong Chương 5Document18 pagesPhantichdiinhluong Chương 5hungpham_sqtt80% (5)
- Hoa-Phan-Tich - Btlt-Ch3330-Chuong-1-2 - (Cuuduongthancong - Com)Document4 pagesHoa-Phan-Tich - Btlt-Ch3330-Chuong-1-2 - (Cuuduongthancong - Com)Đỗ Hoàng AnhNo ratings yet
- Doanthilien - Phan Tich P2O5 Tong Trong Phan Bon Vo CoDocument20 pagesDoanthilien - Phan Tich P2O5 Tong Trong Phan Bon Vo CoTrần Hội100% (2)
- Báo cáo Hóa sinh Trần Mạnh Hùng 20200264Document5 pagesBáo cáo Hóa sinh Trần Mạnh Hùng 20200264Hoàng DiêmNo ratings yet
- CĐ Acid Base 2Document35 pagesCĐ Acid Base 2Nguyễn QuyềnNo ratings yet
- Phân Tích Kim LoạiDocument38 pagesPhân Tích Kim LoạiThắng HàNo ratings yet
- BC Hóa Sinh 01Document4 pagesBC Hóa Sinh 01vy lan trầnNo ratings yet
- Định Lượng Bằng PemanganatDocument3 pagesĐịnh Lượng Bằng PemanganatTâm Anh100% (3)
- Ôn cuối kì 1Document13 pagesÔn cuối kì 1Đào TrangNo ratings yet
- Hoá Phân Tích 2.1 2.3Document3 pagesHoá Phân Tích 2.1 2.3Đạt Nguyễn NgọcNo ratings yet
- To - Vc.bt.05.axit H3po4 (P2o5) Tác D NG V I BazoDocument5 pagesTo - Vc.bt.05.axit H3po4 (P2o5) Tác D NG V I BazoKhoi MinhNo ratings yet
- Bai 4 - PP PermanganatDocument6 pagesBai 4 - PP PermanganatLinh LinhNo ratings yet
- Đề cương và đáp án Hóa phân tích Dược 4Document8 pagesĐề cương và đáp án Hóa phân tích Dược 4Aliza Burhanudin100% (1)
- 10.Xác định đạm tổng và đạm amoniac trong phân đạmDocument24 pages10.Xác định đạm tổng và đạm amoniac trong phân đạmthjenlong14275% (4)
- Vitamin Và Khoáng Chất p2Document51 pagesVitamin Và Khoáng Chất p260 - Trần Thị Huyền TrangNo ratings yet
- BT Hay Và KhóDocument7 pagesBT Hay Và Khóhello hNo ratings yet
- CÂU HỎI ÔN TẬP MÔN HÓA PHÂN TÍCHDocument21 pagesCÂU HỎI ÔN TẬP MÔN HÓA PHÂN TÍCHVăn Học100% (1)
- AmoniacDocument15 pagesAmoniacBe Be Xinh XinhNo ratings yet
- Hệ Thống Bài Tập phần hóa phân tíchDocument12 pagesHệ Thống Bài Tập phần hóa phân tíchgreatdiep100% (2)
- Đề cương TN Hóa phân tíchDocument17 pagesĐề cương TN Hóa phân tíchLinh ĐoànNo ratings yet
- De Thi Hoc Ki 1Document7 pagesDe Thi Hoc Ki 1Phương Hoàng Nguyễn ThuNo ratings yet
- Se HD 1Document13 pagesSe HD 1Tú Đào AnhNo ratings yet
- đề cương thi HOÁ PHÂ TÍCHDocument6 pagesđề cương thi HOÁ PHÂ TÍCHLinh PhạmNo ratings yet
- Chỉ tiêu P2O5 trong bột giặtDocument2 pagesChỉ tiêu P2O5 trong bột giặtTài MinhNo ratings yet
- Phân NPKDocument32 pagesPhân NPKTài MinhNo ratings yet
- bài thêmDocument2 pagesbài thêmTài MinhNo ratings yet
- Báo cáo thực tập- 20078251Document90 pagesBáo cáo thực tập- 20078251Tài MinhNo ratings yet
- câu hỏi qa qcDocument3 pagescâu hỏi qa qcTài MinhNo ratings yet
- Danh Sach Thuc Tap DHPT16A 1Document4 pagesDanh Sach Thuc Tap DHPT16A 1Tài MinhNo ratings yet
- Báo Cáo Thực Tập của Tuấn-20061331Document68 pagesBáo Cáo Thực Tập của Tuấn-20061331Tài MinhNo ratings yet
- CaO VÀ MgO TRONG NPKDocument12 pagesCaO VÀ MgO TRONG NPKTài MinhNo ratings yet
- ĐỀ ÔN MÃU sửa PDFDocument21 pagesĐỀ ÔN MÃU sửa PDFKhang NinhNo ratings yet
- Báo Cáo Thực Tập Tốt Nghiệp Công Ty Xi Măng Hà Tiên i - Trạm Nghiền Phú Hữu - 855788Document136 pagesBáo Cáo Thực Tập Tốt Nghiệp Công Ty Xi Măng Hà Tiên i - Trạm Nghiền Phú Hữu - 855788Tài MinhNo ratings yet
- BÀI TẬP - PTTQDocument11 pagesBÀI TẬP - PTTQTài MinhNo ratings yet
- Báo Cáo Đánh Giá Tác Đ NG Môi Trƣ NGDocument121 pagesBáo Cáo Đánh Giá Tác Đ NG Môi Trƣ NGTài MinhNo ratings yet
- Hoakeo CongnghehoahocDocument305 pagesHoakeo CongnghehoahocTài MinhNo ratings yet
- Dang Ky de Tai - Mau 01 - 2023Document1 pageDang Ky de Tai - Mau 01 - 2023Tài MinhNo ratings yet
- HHX Nhóm 11Document32 pagesHHX Nhóm 11Tài MinhNo ratings yet
- Chuong 4-Sac Ky Khi 2Document125 pagesChuong 4-Sac Ky Khi 2Tài MinhNo ratings yet
- Phân NPKDocument32 pagesPhân NPKTài MinhNo ratings yet
- Bài P2o5Document2 pagesBài P2o5Tài MinhNo ratings yet
- 1111 TdocxDocument2 pages1111 TdocxTài MinhNo ratings yet
- N I DungDocument1 pageN I DungTài MinhNo ratings yet