Professional Documents
Culture Documents
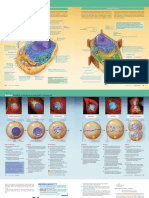
Struktura Sarkomeru
Uploaded by
merloy84Original Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Struktura Sarkomeru
Uploaded by
merloy84Copyright:
Available Formats
Linia Z formuje rusztowanie i łączy cieńkie filamenty z sąsiednich sarkomerów.
Głównymi
strukturalnymi linii Z są a-aktynina i tytyna. A-aktynina łączy aktynę z sąsiadujących sarkomerów z
linią Z. Dwie izoformy występujące w mięśniach szkieletowych (ACTN2 i ACTN3) są głównymi
komponentami lnii Z. Badanie sprawdzające właściwości kurczliwe ACTN 3 u myszy wykazało
redukcję generowanej siły mięśniowej i większą podatność na uszkodzenia indukowane skurczem
ekscentrycznym. Wskazuje to na ważność tego białka w powtarzalnych silnych skurczach
mięśniowych (Seto 2011).
Meromiozyna tworzy dwie części: lekką (light meromyosin – LMM) i ciężką (heavy meromyosin –
HMM). LMM odpowiada 2/3 łańcucha miozyny, jest odpowiedzialne za samo organizację białek
łańucha lekkiego. HMM podzielone na dwa fragmenty: subfragment 1 (S1) zawierający domenę
ruchową składającą się z głów miozyny i subfragment 2 (S2) korespondujący z pozostałą częścią
długości i stanowiący elastyczne połączenie między S1 a LMM.
Meromiozyna jest podjednostką miozyny. Większość aktywności miozyny jest skupiona wokół
regionu HHM – 1. Tam znajdują się głowy miozynowe wykazujące aktywność ATP-azową i
posiadające ‘’binding sites’’. Determinują one prędkość skurczu mięśniowego podczas rozciągnięcia
mięśnia.
Tytyna (konektyna) – łączy linię Z z liiną M, zapewnia niezbędne napięcie mechaniczne do
przywrócenia sarkomeru do długości spoczynkowej po skurczu. Ta rola związana jest z umiejętnością
tytyny do zwiększania swojej długości podczas bycia eksponowaną na siłę rozciągającą oraz powrotu
do początkowej długości gdy działanie siły ustaje. Zachowuje się jak sprężyna molekularna.
Specyficzne właściwości strukturalne końca N rzutują na sztywność tego białka.
Nebulina – kluczowa w określaniu długości aktyny, zaangażowana w skurcz mięśnia (wykazano że
włókna mięśniowe ze zubożoną zawartością nebuliny generują mniejsze napięcie i wykazują większy
koszt energetyczny skurczu). Ciągnie się od linii Z przez całą długość aktyny. W obwodowych rejonach
linii Z nebulina współdziała z desminą co sugeruje że może być ona jednym z czynników
utrzymujących boczne ułożenie miofibryli – kluczowej wartościdla skoordynowanego i wydajnego
skurczu.
Tropomiozyna – reguluje skurcz mięśiowy poprzez blokowanie miejsc aktywnych miozyny na aktynie.
Zapobiega interakcji miofilamentów podczas spoczynku.
Filamenty pośrednie – poza dwoma liniami trójwymiarowa struktura miofilamentów jest zapewnia
przez zorganizowaną sieć filamentów pośrednich które łączą się z obwodowymi częściami
sarkomerów. Nadają one stabilności mechanicznej sarkomerom formując poprzeczne połączenia
pomiędzy sąsiednimi miofibrylami, łącząc także miofibryle z sarkolemą i jądrem komórkowym.
Najbardziej znanymi filamentami pośrednimi są: wimentyna, synemina, nestyna, synkolina,
skelemina, plektyna i desmina.
Wimentyna – znajduje się między innymi w mięśniach szkieletowych, ma 3 części (centralną helisę,
głowę i ogon). Pełni ważną rolę w kotwiczeniu organelli w cytozolu. Jest połączona z jądrem,
siateczką śródplazmatyczną i mitochondriami. Zapewnia elastyczność i integralność komórce.
Synemina i nestyna – oba białka są połączone z desminą i wimentyną w komórkach mięśniowych.
Synemina jest zlokalizowana na obwodzie linii Z kontaktując z desminą i posiada ‘’binding sites’’ dla
a-aktyniny. Nestyna zanika podczas okresu postnatalnego. Prawdopodobnie asystuje przy łączeniu i
rozłączaniu struktur komórki podczas podziałów komórkowych.
Synkolina – wykazuje wysoką zawartośc w sercu i mięśniach szkieletowych, wspódziała z desminą i
DGC. Synkolina znajduje się na złączu nerwowo mięśniowym, linii Z i sarkolemie. Może być
zaangażowana w organizację filamentów pośrednich i ich połączenia z sarkolemą poprzez DGC.
Skelemina – zlokalizowana w linii M, tam gdzie MYOM 1. Podczas wczesnych stadiów rozwoju
komórki pośredniczy w połączeniu z ECM
Plektyna – łączy filamenty pośrednie z kostamerami, pozwala na połączenie sąsiednich miofibryli do
linii Z i bwodowch sarkomerów do sarkolemy. Poza tym kotwiczy takie organella jak mitochondria i
jądro komórkowe do sieci filamentów pośrednich.
Desmina – główny komponent filamentów pośrednich, jej interakcja z innymi filamentami pośrednimi
zapewnia ciągnącą się sieć pokrywającą cytoszkielet zapewniającą przestrzenną relację pomiędzy
aparatem kurczliwym a innymi organellami. Zapewnia komórce integralność, efektywną transmisję
siły i uczestniczy w sygnalizacji mechanochemicznej. Łączy się również z kostamerami mając wpływ
na organizację i regulację ECM. W komórce mięśnia szkieletowego znajduje się wokół linii Z.
Desmina jest także kluczowa w początkowych stadiach rozwoju komórki definiując strukturę
komórek mięśni i serca. Udowodniono, że utrata desminy powoduje dezorganizację struktury mięśni
szkieletowych, spadek generowanej siły i wydajność jej transferu we włóknie i pomiędzy nimi, co
przekłada się na słabość włókna mięśniowego i jego większą podatność na uszkodzenia.
You might also like
- Mięśniowy KontynuacjaDocument5 pagesMięśniowy Kontynuacjamerloy84No ratings yet
- Fizjologia Zwierząt Zootechnika Semestr IIIDocument172 pagesFizjologia Zwierząt Zootechnika Semestr IIIOliwka DembińskaNo ratings yet
- Notatki FizjologiaDocument367 pagesNotatki FizjologiaSebastian KrychNo ratings yet
- Tkanka MiesniowaDocument9 pagesTkanka MiesniowaRobert WadlewskiNo ratings yet
- Mies NieDocument16 pagesMies NieKatarzyna KonopackaNo ratings yet
- CytoszkieletDocument2 pagesCytoszkieletkarolina drabNo ratings yet
- Cytoszkielet_i_jego_funkcjeDocument19 pagesCytoszkielet_i_jego_funkcjeWhite WhiteeNo ratings yet
- Szkielet Komórki - Histologia NotatkiDocument2 pagesSzkielet Komórki - Histologia NotatkiEwaNo ratings yet
- Materiały Szkoleniowe PFI Personal Trainer - Fizjologia PDFDocument12 pagesMateriały Szkoleniowe PFI Personal Trainer - Fizjologia PDFslimshaderNo ratings yet
- Biologia Medyczna - Tensegralność Komórek - Kolokwium I Część Druga-2Document10 pagesBiologia Medyczna - Tensegralność Komórek - Kolokwium I Część Druga-2Wiktoria MiętkiewiczNo ratings yet
- Histologia - Miesnie +Document8 pagesHistologia - Miesnie +Adam MajchrzakNo ratings yet
- fiszki do druku miÄÅnieDocument7 pagesfiszki do druku miÄÅnienelNo ratings yet
- Mięsnie 2012Document35 pagesMięsnie 2012joozeckNo ratings yet
- Czynności Komórek MięśniowychDocument9 pagesCzynności Komórek Mięśniowychmerloy84No ratings yet
- Łańcuchy Mięśniowo-Powięziowe. Charakterystyka Taśm AnatomicznychDocument8 pagesŁańcuchy Mięśniowo-Powięziowe. Charakterystyka Taśm AnatomicznychEwaMyszkaNo ratings yet
- Skrypt Z Fizjologii-Do EgzaminuDocument74 pagesSkrypt Z Fizjologii-Do EgzaminuangiorehNo ratings yet
- Połączenia MiędzykomórkoweDocument1 pagePołączenia MiędzykomórkoweAla CzajkaNo ratings yet
- Mechanizm_slizgowy_skurczu_miesniaDocument24 pagesMechanizm_slizgowy_skurczu_miesniasmiesznichannelNo ratings yet
- Fizjologia Skrypt Wszystko Najważniejsze PDFDocument92 pagesFizjologia Skrypt Wszystko Najważniejsze PDFAgustina AgazzaniNo ratings yet
- Tkanki Zwierzęce Liceum RozszerzenieDocument31 pagesTkanki Zwierzęce Liceum Rozszerzeniebiologia chemiaNo ratings yet
- Notatki Tkanka NerwowaaaDocument1 pageNotatki Tkanka NerwowaaaignacyNo ratings yet
- Tkanka Łączna, Mięśniowa, NerwowaDocument38 pagesTkanka Łączna, Mięśniowa, NerwowaAneta KuleszaNo ratings yet
- Mięśnie PDFDocument4 pagesMięśnie PDFmnkNo ratings yet
- BiologiaDocument1 pageBiologiaNikola WronaNo ratings yet
- Ból Z Perspektywy Fizjologii - Rozdział IIDocument8 pagesBól Z Perspektywy Fizjologii - Rozdział IIMateusz StecNo ratings yet
- Układ NerwowyDocument9 pagesUkład Nerwowymerloy84No ratings yet
- NeurofizjologiaDocument20 pagesNeurofizjologiaKrisNo ratings yet
- Histologia Bez Spójników PDFDocument328 pagesHistologia Bez Spójników PDFjulkynNo ratings yet
- Mat MP 21 11 2017Document60 pagesMat MP 21 11 2017amandaNo ratings yet
- Neuro MapaDocument8 pagesNeuro MapaLuis EsbaNo ratings yet
- Fizjologia Zwierząt Nerwowy ŚciągiDocument1 pageFizjologia Zwierząt Nerwowy ŚciągiOliwka DembińskaNo ratings yet
- 13-Układ KrążeniaDocument4 pages13-Układ Krążeniamacias grabowskiNo ratings yet
- Od Chromatyny Do ChromosomuDocument18 pagesOd Chromatyny Do ChromosomuWaifuNoLaifuNo ratings yet
- Test Powtórkowy 2 - Komórka I Podziały KomórkoweDocument8 pagesTest Powtórkowy 2 - Komórka I Podziały KomórkowePolomaniac ŻubrNo ratings yet
- Anatomia - Notatki PDFDocument71 pagesAnatomia - Notatki PDFZosia KrzewińskaNo ratings yet
- Tkanki Przed SprawdzianemDocument7 pagesTkanki Przed SprawdzianemAgnieszka GrajekNo ratings yet
- Budowa Makroskopowa I Mikroskopowa MiesniDocument27 pagesBudowa Makroskopowa I Mikroskopowa Miesnikulinskamaria19No ratings yet
- Neuron 07.11.2021Document15 pagesNeuron 07.11.2021Kasia FielmannNo ratings yet
- Od Chromatyny Do ChromosomuDocument17 pagesOd Chromatyny Do ChromosomuOla MachowskaNo ratings yet
- Biosynteza Białka 240313 174046Document78 pagesBiosynteza Białka 240313 174046julianna.lisownaNo ratings yet
- Polaczenia Miedzykomorkowe W TkaDocument17 pagesPolaczenia Miedzykomorkowe W TkaMaksymilian SikorskiNo ratings yet
- SzkieletDocument8 pagesSzkieletjakubNo ratings yet
- Aaa Podział Mitotyczny KomórkiDocument3 pagesAaa Podział Mitotyczny KomórkiJulia GajdowskaNo ratings yet
- Biosynteza BiałkaDocument24 pagesBiosynteza BiałkaJulita NapieralskaNo ratings yet
- Niektóre Pierwiastki W Połączeniu Z Białkami Tworzą Ważne BiDocument3 pagesNiektóre Pierwiastki W Połączeniu Z Białkami Tworzą Ważne Biweronika.gulik25No ratings yet
- 35 Budowa i Funkcjnowanie Ukladu MiesniowegoDocument8 pages35 Budowa i Funkcjnowanie Ukladu Miesniowegobf7qm7v65tNo ratings yet
- Biologia-Genetyka MolekularnaDocument4 pagesBiologia-Genetyka MolekularnaKarolina PelcNo ratings yet
- Struktura I Funkcje Bariery Krew MózgDocument16 pagesStruktura I Funkcje Bariery Krew MózgOla PoloczekNo ratings yet
- Neurologia - Wykład + ĆwiczeniaDocument35 pagesNeurologia - Wykład + Ćwiczeniamati.haj197No ratings yet
- Notatki - NeurohistologiaDocument14 pagesNotatki - NeurohistologiaKrzysztof CzaudernaNo ratings yet
- J.-Górski-J.Celichowski Fizjologiczne Podstawy Wysiłku FizycznegoDocument93 pagesJ.-Górski-J.Celichowski Fizjologiczne Podstawy Wysiłku FizycznegoЭльмира АлиеваNo ratings yet
- Genetyka MonekularnaDocument8 pagesGenetyka Monekularnapar-olkNo ratings yet
- Histologia Skrypt Z SawickiegoDocument156 pagesHistologia Skrypt Z SawickiegoMagdalena Rejmer100% (1)
- Biologia Campbella - Fragmenty - Komã Rka, Podziaå Y, Rã Å Norodnoå Ä Ssakã WDocument6 pagesBiologia Campbella - Fragmenty - Komã Rka, Podziaå Y, Rã Å Norodnoå Ä Ssakã WДарья СимдянкинаNo ratings yet
- Biomechanika - AWFDocument30 pagesBiomechanika - AWFKrzysztof StrugałaNo ratings yet
- Polaczenia Miedzykomorkowe W Tkankach ZwierzecychDocument17 pagesPolaczenia Miedzykomorkowe W Tkankach Zwierzecychkkucfir14No ratings yet
- Docero - PL Cytofizjologia Jdra Komorkowego Podziay KomorkoweDocument4 pagesDocero - PL Cytofizjologia Jdra Komorkowego Podziay KomorkoweMateusz BabijNo ratings yet
- Tkanka NerwowaDocument3 pagesTkanka NerwowamnkNo ratings yet
- Neurony, A Aktywność MózguDocument10 pagesNeurony, A Aktywność MózguAla de FlassilierNo ratings yet
- Roger Klos ABK2Document5 pagesRoger Klos ABK2Bartłomiej SzczygiełNo ratings yet
- Roger Klos ABK2Document5 pagesRoger Klos ABK2Bartłomiej SzczygiełNo ratings yet
- 2 Rok FTJMS Akt.22.11Document1 page2 Rok FTJMS Akt.22.11merloy84No ratings yet
- Roger Klos ABK2Document5 pagesRoger Klos ABK2Bartłomiej SzczygiełNo ratings yet
- Roger Klos ABK2Document5 pagesRoger Klos ABK2Bartłomiej SzczygiełNo ratings yet
- Roger Klos ABK2Document5 pagesRoger Klos ABK2Bartłomiej SzczygiełNo ratings yet
- English For Physiotherapy, Joanna Ciecierska, PodręcznikDocument120 pagesEnglish For Physiotherapy, Joanna Ciecierska, Podręcznikmerloy84100% (1)
- RFD I CCDocument14 pagesRFD I CCmerloy84No ratings yet
- Podstawy Diagnostyki W Treningu PersonalnymDocument100 pagesPodstawy Diagnostyki W Treningu Personalnymmerloy84No ratings yet
- Struktura Atletyzmu I LokomocjiDocument22 pagesStruktura Atletyzmu I Lokomocjimerloy84No ratings yet
- Historia, Filozofia Oraz Zasady Osteopatii FICO POLSKA V1Document30 pagesHistoria, Filozofia Oraz Zasady Osteopatii FICO POLSKA V1merloy84No ratings yet
- Strategie 2.0 Jakub SurmaczDocument33 pagesStrategie 2.0 Jakub Surmaczmerloy84No ratings yet
- PDF ZARZĄDZENIE 109-2021 - Organizacja Roku Akademickiego 2021-22 (00000003)Document5 pagesPDF ZARZĄDZENIE 109-2021 - Organizacja Roku Akademickiego 2021-22 (00000003)merloy84No ratings yet
- Izometria OscylacyjnaDocument2 pagesIzometria Oscylacyjnamerloy84No ratings yet
- Biomechanics and Motor ControlDocument64 pagesBiomechanics and Motor Controlmerloy84No ratings yet
- FRC® (W Trzech Zdaniach)Document13 pagesFRC® (W Trzech Zdaniach)merloy84No ratings yet
- Advanced Exercise PhysiologyDocument94 pagesAdvanced Exercise Physiologymerloy84No ratings yet
- TerminarzDocument2 pagesTerminarzmerloy84No ratings yet
- PSYCHOLOGIA KlinicznaDocument61 pagesPSYCHOLOGIA Klinicznamerloy84No ratings yet
- IOC Manual of Sports InjuriesDocument43 pagesIOC Manual of Sports Injuriesmerloy84No ratings yet
- System Ochrony Zdrowia - SzwajcariaDocument21 pagesSystem Ochrony Zdrowia - Szwajcariamerloy84No ratings yet
- Zaburzenia LękoweDocument13 pagesZaburzenia Lękowemerloy84No ratings yet
- ZABURZENIADocument20 pagesZABURZENIAmerloy84No ratings yet
- Mechanizmy Zmęczenia Podczas Ćwiczeń o Wysokiej IntensywnościDocument5 pagesMechanizmy Zmęczenia Podczas Ćwiczeń o Wysokiej Intensywnościmerloy84No ratings yet
- Trenowanie Do Upadku MięśniowegoDocument2 pagesTrenowanie Do Upadku Mięśniowegomerloy84No ratings yet
- Wydzielanie WewnętrzneDocument6 pagesWydzielanie Wewnętrznemerloy84No ratings yet
- Unikające Zaburzenia OsobowiściDocument7 pagesUnikające Zaburzenia Osobowiścimerloy84No ratings yet
- Wysiłek FizycznyDocument15 pagesWysiłek Fizycznymerloy84No ratings yet
- Medycyna Fizykalna - SaunaDocument6 pagesMedycyna Fizykalna - Saunamerloy84No ratings yet