Professional Documents
Culture Documents
Linh M I
Uploaded by
Linh Nguyễn0 ratings0% found this document useful (0 votes)
27 views3 pagescute
Original Title
linh-mới
Copyright
© © All Rights Reserved
Available Formats
DOCX, PDF, TXT or read online from Scribd
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this Documentcute
Copyright:
© All Rights Reserved
Available Formats
Download as DOCX, PDF, TXT or read online from Scribd
0 ratings0% found this document useful (0 votes)
27 views3 pagesLinh M I
Uploaded by
Linh Nguyễncute
Copyright:
© All Rights Reserved
Available Formats
Download as DOCX, PDF, TXT or read online from Scribd
You are on page 1of 3
1.
Biểu thức của nội năng là: ΔU=q+A
2. Hệ đồng thể là: hệ không tồn tại các bề mặt phân chia, các tính chất của hệ không
thay đổi hoặc thay đổi liên tục từ điểm này đến điểm khác trong hệ
3. Biểu thức của enthalpy là H = U + PV
4. Tính hằng số cân bằng K của quá trình chuyển hóa glycogen trong bắp cơ của người
tạo lactat, gluco-1-photphat chuyển thành gluco-6-phosphat với sự có mặt của men
phosphoglucomutase. Quá trình thực nghiệm tìm ra biến thiên năng lượng tự do tiêu
chuẩn của quá trình ∆ G=1727 cal /mol : K=18,45
5. Trong hệ đẳng nhiệt, đẳng áp, nếu ∆ G<Q: Quá trình tự xảy ra
6. Hệ đồng nhất là : Hệ có thành phần và tính chất ở mọi phần của hệ như nhau
7. Ý nghĩa của thể đẳng áp đẳng nhiệt: Là tiêu chuẩn xét đoán chiều tự xảy ra và điều
kiện cân bằng của các quá trình trong hệ đẳng áp, đẳng nhiệt
8. ∆ S là tiêu chuẩn để xét chiều của hệ: Hệ cô lập
9. Phản ứng enzyme hóa L-aspartat thành fumarat và ion amoni diễn ra theo phương
trình L-aspartat ( nước) ++Fumarat(nước) + NH4 + (nước). Biets KCB của phản ứng ở
29oC là 7,4.10^-3M và thực nghiệm xác định ∆ H^310=-14,5 kcal/mol. Hãy tính KCB
ở 37oC: 0,0138M
10. Chọn phát biểu đúng, biết: ∆ G0 298=5,383kJ, phản ứng tự diễn ra theo chiều
nghich
11. Ý nghĩa của entropy: Thước đo mức độ trật tự của hệ
12. Chọn phát biểu đúng: “ Đại lượng nào sau đây không phải hàm trạng thái:” Nhiệt
13. Thông số cường độ là: Những thông số không phụ thuộc vào lượng chất
14. Biểu thức của thế đẳng áp đẳng nhiệt: G = H – TS
15. Phương trình Van’t Hoff có dạng: ∆ G’=R.T.Ink
16. Cân bằng pha: Là dạng cân bằng trong đó xảy ra sự vận chuyển vật chất giữa các
pha
17. Độ dốc của các đường OA, OB, OC trong gian đồ pha của H2O được giải thích dựa
trên: Phương trình Claslus-Clapeyron
18. Định nghĩa dung dịch đẳng trương: Là dung dịch có áp suất thẩm thấu, độ hạ điểm
bằng giống như dịch sinh học và không làm thay đổi thể tích tế bào khi trộn với
tế bào vào dung dịch đó
19. Để độ hòa tan tăng lên 10% cần nghiền nhỏ tiểu phần tới kích thước bao nhiêu, biết σ
= 100 dyn/cm, V=50 cm3, nhiệt độ 27oC. Biết độ tan tuân theo phương trình
Hibebrand – Scott có dạng log (S/SO) = : r=42 nm
20. Định nghĩa pha: là tập hợp những phần đồng thể giống nhau của một hệ, giới hạn
với những phần khác bởi bề mặt phân chia
21. Trên thực tế 1 lít dung dịch có chứa 5.85 gam NaCl có áp suất thẩm thấu đo được là
4,685 atm. Hệ số Van’t Hoff của dung dịch là: 1,92
22. Tính áp suất trong bình thuốc phun mù ở 25oC của thể tích 250cm3 trong đó dung
tích của dung dịch thuốc và cuống van chiếm chỗ là 160 cm3, trên mặt thuốc chứa
0,04 mol khí N2: P=1,1.10^6 N.m-2
23. Phát biểu nào sau đây không đúng: khi dung dịch rắn có cấu trúc vô định hình,
phân tử các chất rắn phân bố sắp xếp như dung dịch
24. Vùng nằm dưới và trong đường cong: Hệ dị thế có 2 pha lỏng
25. Khái niệm cấu tử: Là chất hợp phần mà thành phần mỗi pha trong hệ được xác
định bởi nồng độ của nó. Số cấu tử của hệ là số chất hợp phần tối thiểu cần thiết
đủ để xác minh thành phần một pha bất kỳ của hệ ở trạng thái cân bằng
26. Hãy pha chế 200ml dung dịch thimerosal: 0,04 gam thimerosal + 1,794 gam NaCl
thêm nước vừa đủ 200ml
27. Quy tắc pha cho biết: Số bậc tự do = Tổng số thống số - Tổng số phương trình liên
hệ giữa các thông số
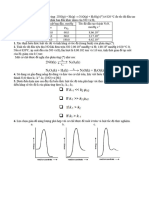
28. Dựa vào đồ thị, sắp xếp đúng các đường: (1) Bộ thở (2) BỘ min (3) hỗn hợp eutecti
(4) dung dịch rắn
29. Trên thực tế tại 25oC 1 lít dung dịch có chứa 36 gam glucose có áp suất 4,792 atm:
0,98
30. Số bậc tự do: Là thông số tối đa có thể tùy ý thay đổi và vẫn không làm thay đổi
số pha trong hệ, không làm biến mất hoặc xuất hiện pha mới
31. Tỷ lệ khối lượng giữa pha lỏng 1 giàu nước và pha lỏng 2 giàu phenol: 1/3
32. Định nghĩa dung dịch rắn: Dung dịch rắn là hệ phân tán trong đó tiểu phân của
các chất rắn phân tán vào nhau có kích thước phân tử hoặc nguyên tử
33. Điều kiện cân bằng pha là: Nhiệt độ của tất cả các pha như nhau , áp suất trong
các pha như nhau, thể hóa học của mỗi cấu tử trong các pha như nhau
34. Dung dịch thuốc tiêm 1% dược chất A có ∆ Tb=0,08oC cần bao nhiêu gam NaCl:
1gam A + 0,76 gam NaCl thêm nước vừa đủ 100ml
35. Biểu thức quan hệ giữa số cấu tử và số hợp phần: Số cấu tử = số chất hợp phần – Số
phương trình hóa học liên quan giữa các chất hợp phần
36. Tính độ dẫn điện lượng ở độ pha loãng vô hạn: γ =HP = 373,2
37. Các yếu tố ảnh hưởng đến độ dẫn đương lượng: Bản chất, nhiệt độ, nồng độ
38. Định nghĩa độ dẫn điện riêng: Là độ dẫn điện của một dung dịch chất điện ly nằm
giữa hai điện cực có tiết diện 1cm2 và cách nhau 1cm
39. Đơn vị đo của độ dẫn điện riêng là: -1.cm2-1
40. Để phản ứng vừa đủ với 5ml dung dịch HA: 4,75
41. Các yếu tố ảnh hưởng đến độ dẫn điện riêng: bản chất, nồng độ, nhiệt độ
42. Để phản ứng vừa đủ với 5ml dung dịch HA: 6,16
43. Đơn vị đo của độ dẫn điện mol:
44. Thực nghiệm bằng phương pháp đo độ dẫn điện xác định: 0,017
45. Đo điện trở của dung dịch KCL 0,02N ở 25oC: 6,977.10^4
46. Định nghĩa độ dẫn đương lượng của một chất điện ly ở nồng độ xác định: độ dẫn gây
nên bởi tất cả các ion có trong một đương lượng gam chất ở nồng
47. Thực nghiệm xác định độ dẫn điện đương lượng: 390,7
48. Độ dẫn điện mol: là độ dẫn gây ra bởi tất cả các ion có trong 1 mol chất điện ly ở
nồng độ đã cho
49. Độ hạ bằng điểm của dung dịch 0,1m: 0,011
50. Phản ứng xảy ra ở thế điện cực của điện cực hydro: 2H+ +2e -> H2
51. Tính biến thiên năng lượng tự do của phản ứng trong pin: Cd + Cu2 = Cd2+ + Cu.
Cho thực nghiệm đo được sức điện động của pin là + 0,75V: ∆ G=-144,75 k.J/mol
52. Đặc điểm cấu tạo của điện cực hydro: Gồm thanh Pt được mạ 1 lớp muội Pt, những
trong dung dịch chứa ion H+ (a=1) và khí hydro được sục liên tục vao dung dịch
quanh điện cực tạo áp suất 1atm
53. Phản ứng xảy ra ở thế điện cực của điện cực calomen: Hg2Cl2 + 2e = 2Hg + 2Cl-
54. Sức điện động của mạch gồm điện trực: 0,51
55. Trình bày đặc điểm cấu tạo của điện cực calomen: gồm thủy ngân nằm cân bằng với
ion Cl- gián tiếp qua muối ít tan Hg2Cl2
56. Dung dịch đặt giữa hai điện cực: pH = 12,2
57. Tính sức điện động của pin ở 25oC: 0,104V
58. Phản ứng xảy ra ở thế điện cực của điện cực quihydro:
59. Tính sức điện động của pin bao gồm điện cực Ag và điện cực Pb: +0,925V
60. Mối quan hệ giữa sức điện động của pin và thông số nhiệt động của phản ứng:
61. Sức điện động pin (-) Pt, H2: 3,69
62. Phản ứng xảy ra ở thế điện cực của điện cực bạc clorid: AgCl + 1e -> Ag + Cl-
63. Sức điện động của mạch điện gồm điện cực calomen bão hòa: 5,42
64. Đặc điểm cấu tạo của điện cực bạc clorid: Gồm một dây Ag được phủ một lớp
AgCl, tất cả được nhúng trong dung dịch có chứa anion Cl-
65. Tính hằng số cân bằng ở 25oC của phản ứng Zn + Cu2+: K=10^37
66. Để xác định pH của một dung dịch acid: 4,57
67. Đặc điểm cấu tạo của điện cực kim loại: Thanh kim loại nhúng trong dung dịch
chứa cation của kim loại đó
68. Tính K phân ly của acid avalproic: 1,11.10^5
69. Tính thế điện cực khi nhúng platin vào dung dịch chứa ion Fe3+ trong môi trường
acid: E=0,75V
70. Chọn phát biểu đúng nhất: Chất xúc tác là chất làm thay đổi vận tốc phản ứng và
không biến đổi về chất và lượng sau phản ứng
71. Trình bày cách tiến hành phương pháp lão hóa cấp tốc: Xác định động học phản ứng
ở nhiệt độ cao hơn nhiệt độ bảo quản, xác định hằng số k tại 2-5 nhiệt độ, tính
Ea, từ đó tính thời gian phân hủy tại nhiệt độ bảo quản
72. Khi thực hiện lão hóa cấp tốc để xác định tuổi thọ của thuốc A: 1,96
73. Trình bày nguyên tắc xác định bậc của phản ứng đơn giản bằng phương đồ thị: xây
dựng đồ thị sự phụ thuộc của nồng độ vào thời gian. Tìm xem dạng nào của hàm
số cho đường biểu diễn là đường thẳng thì bậc của phản ứng cần tìm ứng dạng
đó
74. Phương trình Arrthenius:
75. Cho phản ứng phân hủy glucose có nồng độ ban đầu 0,056M trong môi trường acid:
t=38,85 giờ
76. Tốc độ phản ứng có thể được biểu thị như sau: Là sự biến đổi nồng dộ chất tham gia
hoặc sản phẩm theo thời gian
77. Tính thời gian bán hủy của phản ứng phân hủy glucose có nồng độ ban đầu 0,056M
trong môi trường HCl 0,35N: t1/2=36,1 giờ
78. Theo dõi sự phân hủy của glucose có nồng độ ban đầu 0,056M trong môi trường HCL
0,35N ở 140oC người ta thu được nồng độ glucose sau 2 giờ là 0,0531 mol/L.
k=0,0265 h-1
79. Hằng số tốc độ phản ứng: 16,8 ph
80. Hằng số tốc độ phản ứng: 6,81 ph
You might also like
- Bốn khám phá Căn bản Đặc biệt quan trọng cho Hóa học: Four basic Discoveries Especially Important for ChemistryFrom EverandBốn khám phá Căn bản Đặc biệt quan trọng cho Hóa học: Four basic Discoveries Especially Important for ChemistryNo ratings yet
- Thi Nghiem Hoa Ly DH Bach KhoaDocument19 pagesThi Nghiem Hoa Ly DH Bach KhoaLiễu Quỳnh0% (1)
- Da Nangh10de de NghiDocument7 pagesDa Nangh10de de Nghipham kienNo ratings yet
- Đè cương ôn tậpDocument5 pagesĐè cương ôn tậpquynhquynh1324No ratings yet
- HOÁ HỌC HỮU CƠDocument15 pagesHOÁ HỌC HỮU CƠ23a3201d0007No ratings yet
- Bai Tap Hoa LyDocument22 pagesBai Tap Hoa Lyasdasd asdasdNo ratings yet
- TN Hóa Lý Thi 1Document19 pagesTN Hóa Lý Thi 1Tuấn TàiNo ratings yet
- Bài So N TnhlyDocument10 pagesBài So N TnhlyYul NguyễnNo ratings yet
- BÀI TẬP HÓA LÝDocument6 pagesBÀI TẬP HÓA LÝPhạm Mỹ Trinh100% (1)
- De Va Dap An Mon Hoa Hoc 2018-2019Document15 pagesDe Va Dap An Mon Hoa Hoc 2018-2019Hải ĐứcNo ratings yet
- Bai Tap Hoa Ly - Chuong 6,7Document5 pagesBai Tap Hoa Ly - Chuong 6,7Tín Nguyễn TrầnNo ratings yet
- Hoa Dai Cuong Bo Sung Ly Thuyet Hoa - Dai Cuong Cuoi KyDocument27 pagesHoa Dai Cuong Bo Sung Ly Thuyet Hoa - Dai Cuong Cuoi KyKhánh NguyênNo ratings yet
- Hoa Ly - T2Document73 pagesHoa Ly - T2Panh HoàngNo ratings yet
- Đề minh họa Hóa lí 1Document4 pagesĐề minh họa Hóa lí 1Ngọc YênNo ratings yet
- DUYÊN HẢI - ĐỀ 10Document20 pagesDUYÊN HẢI - ĐỀ 10Mạc Đức TháiNo ratings yet
- BÀI TẬP HÓA LÝ DƯỢCDocument10 pagesBÀI TẬP HÓA LÝ DƯỢClamoanh24985No ratings yet
- Đề - QG2 2005 VCDocument3 pagesĐề - QG2 2005 VCTrần BíNo ratings yet
- NHIỆT HÓA HỌCDocument9 pagesNHIỆT HÓA HỌCTân DuyNo ratings yet
- Vung Cao Viet Bac de Gioi Thieu Mon Hoa Duyen Hai Khoi 10-2018Document5 pagesVung Cao Viet Bac de Gioi Thieu Mon Hoa Duyen Hai Khoi 10-2018Nguyên PhongNo ratings yet
- KĐA_BÀI-TẬP-ĐIỆN-PHÂN-30.4Document3 pagesKĐA_BÀI-TẬP-ĐIỆN-PHÂN-30.4dvt.080202No ratings yet
- Đề Luyện Số 1Document6 pagesĐề Luyện Số 1Bé ShiNo ratings yet
- BÀI TẬP HÓA LÝDocument8 pagesBÀI TẬP HÓA LÝHà Thúc Nguyên BảoNo ratings yet
- Hóa lúDocument15 pagesHóa lúkhangdhh211052No ratings yet
- ĐỀ CƯƠNG ÔN TẬP lý thuyếtDocument5 pagesĐỀ CƯƠNG ÔN TẬP lý thuyếtHuỳnh Nhật QuyênNo ratings yet
- Hoa Hoc Dai CuongDocument29 pagesHoa Hoc Dai Cuongvanxocodon100% (1)
- Hoá Phân Tích 1 - LTDocument270 pagesHoá Phân Tích 1 - LTThiện HuỳnhNo ratings yet
- Chương 2Document51 pagesChương 2Hoang Nguyen Anh ThuNo ratings yet
- Cân bằng hóa học.ĐềDocument11 pagesCân bằng hóa học.ĐềKiều Viết NhânNo ratings yet
- HDC Phan 2Document54 pagesHDC Phan 2Minh ĐạtNo ratings yet
- Đề KTTX 8Document5 pagesĐề KTTX 8Pháp TrầnNo ratings yet
- De Hoa 10Document22 pagesDe Hoa 10tiena6847No ratings yet
- Hoa 10 - HA GIANGDocument21 pagesHoa 10 - HA GIANGTrần Nhật Khánh NguyễnNo ratings yet
- I.3.3 Sự hòa tan của lỏng trong lỏng (tiếp)Document10 pagesI.3.3 Sự hòa tan của lỏng trong lỏng (tiếp)Phương TrầnNo ratings yet
- Trại Hè Phương Nam Lần Vi - Môn Hoá HọcDocument3 pagesTrại Hè Phương Nam Lần Vi - Môn Hoá HọcTrương Gia BảoNo ratings yet
- ĐỀ KIỂM TRA THÁNG 3 2022 ChuẩnDocument3 pagesĐỀ KIỂM TRA THÁNG 3 2022 ChuẩnThắng ĐứccNo ratings yet
- Bai Tap HL 1 - TN108Document18 pagesBai Tap HL 1 - TN108Lộc TrươngNo ratings yet
- Cac Yu T NH HNG DN TC D PHN NGDocument6 pagesCac Yu T NH HNG DN TC D PHN NGHọc SáchNo ratings yet
- Cau Hoi On TapDocument13 pagesCau Hoi On TapNanNo ratings yet
- HÓA SINH THỰC VẬTDocument287 pagesHÓA SINH THỰC VẬThoanganhaNo ratings yet
- ĐỀDocument3 pagesĐỀLê LâmNo ratings yet
- CH3051 - Chuong 6 - CB LR - SVDocument3 pagesCH3051 - Chuong 6 - CB LR - SVĐặng Trần HiếuNo ratings yet
- 04.1-Hieu Ung Nhiet Cua Cac Qua Trinh Hoa Hoc 211Document30 pages04.1-Hieu Ung Nhiet Cua Cac Qua Trinh Hoa Hoc 211Vĩnh Tân TrầnNo ratings yet
- 10 Hoa - CBH Ha NamDocument26 pages10 Hoa - CBH Ha NamHoà Phạm xuân100% (1)
- Nhom QG - Buoi 2 - HSDocument4 pagesNhom QG - Buoi 2 - HSKiên TrầnNo ratings yet
- 3.Hóa 10 - Lê Quý Đôn - Đà NẵngDocument7 pages3.Hóa 10 - Lê Quý Đôn - Đà NẵngkhánhNo ratings yet
- Đề 1Document113 pagesĐề 1Trang Nguyễn100% (1)
- Bài 2 Nhiệt động hóa họcDocument29 pagesBài 2 Nhiệt động hóa họchoctrenlop080905No ratings yet
- ĐỀ HÓA 40 CÂU TỔNG HỢPDocument4 pagesĐỀ HÓA 40 CÂU TỔNG HỢPTrần Nguyễn TuấnNo ratings yet
- Hung Yen - Hoahoc10Document16 pagesHung Yen - Hoahoc10Đỗ Đăng KhoaNo ratings yet
- ĐỀ CƯƠNG HÓA LÝ DƯỢC 2022Document13 pagesĐỀ CƯƠNG HÓA LÝ DƯỢC 2022Que Hoang Thi HuongNo ratings yet
- Hoa Dai Cuong Quyen Chuong 3Document102 pagesHoa Dai Cuong Quyen Chuong 3thuongmobile9999No ratings yet
- Baocaothuchanh HLDocument27 pagesBaocaothuchanh HLNguyễn Chấn PhongNo ratings yet
- A. Lý thuyết chung khi giải các bài toán hóa học vô cơDocument20 pagesA. Lý thuyết chung khi giải các bài toán hóa học vô cơbi_hpu2No ratings yet
- Đề luyện 4-HVDocument14 pagesĐề luyện 4-HVDxng 1No ratings yet
- CH3051 - Chương 2. Lý thuyết cân bằng phaDocument5 pagesCH3051 - Chương 2. Lý thuyết cân bằng phaLe Van AnhNo ratings yet
- ĐỀ CHÍNH THỨC HOÁ 11 2023 2024Document2 pagesĐỀ CHÍNH THỨC HOÁ 11 2023 2024Giang Hương (Tom Dino)No ratings yet
- De Cuong Hoa Ly Duoc-He Lien Thong-Dh Dai NamDocument25 pagesDe Cuong Hoa Ly Duoc-He Lien Thong-Dh Dai NamPhan Thanh Thanh100% (1)
- tốc độ phản ứngDocument22 pagestốc độ phản ứngAnh VuNo ratings yet