Professional Documents
Culture Documents
Uv-Vis: Kurva Kalibrasi Paracetamol
Uv-Vis: Kurva Kalibrasi Paracetamol
Uploaded by
Mutia Ambar Permatasari0 ratings0% found this document useful (0 votes)
26 views9 pagesThe document describes procedures for preparing standard solutions and using UV-Vis spectroscopy and iodimetry to determine the concentration of samples. Specifically:
1. It details how to make a 500 ppm stock solution of paracetamol and generate a calibration curve by taking absorbance measurements of standards ranging from 3.5-6.5 ppm.
2. The absorbance of a sample is measured and used to determine its concentration via the linear regression equation from the calibration curve.
3. Iodimetry is also described to determine the concentration of vitamin C and iodine via titration with sodium thiosulfate of known concentration. Concentrations are calculated based on the titration volumes
Original Description:
Original Title
PERHITUNGAN
Copyright
© © All Rights Reserved
Available Formats
DOCX, PDF, TXT or read online from Scribd
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentThe document describes procedures for preparing standard solutions and using UV-Vis spectroscopy and iodimetry to determine the concentration of samples. Specifically:
1. It details how to make a 500 ppm stock solution of paracetamol and generate a calibration curve by taking absorbance measurements of standards ranging from 3.5-6.5 ppm.
2. The absorbance of a sample is measured and used to determine its concentration via the linear regression equation from the calibration curve.
3. Iodimetry is also described to determine the concentration of vitamin C and iodine via titration with sodium thiosulfate of known concentration. Concentrations are calculated based on the titration volumes
Copyright:
© All Rights Reserved
Available Formats
Download as DOCX, PDF, TXT or read online from Scribd
0 ratings0% found this document useful (0 votes)
26 views9 pagesUv-Vis: Kurva Kalibrasi Paracetamol
Uv-Vis: Kurva Kalibrasi Paracetamol
Uploaded by
Mutia Ambar PermatasariThe document describes procedures for preparing standard solutions and using UV-Vis spectroscopy and iodimetry to determine the concentration of samples. Specifically:
1. It details how to make a 500 ppm stock solution of paracetamol and generate a calibration curve by taking absorbance measurements of standards ranging from 3.5-6.5 ppm.
2. The absorbance of a sample is measured and used to determine its concentration via the linear regression equation from the calibration curve.
3. Iodimetry is also described to determine the concentration of vitamin C and iodine via titration with sodium thiosulfate of known concentration. Concentrations are calculated based on the titration volumes
Copyright:
© All Rights Reserved
Available Formats
Download as DOCX, PDF, TXT or read online from Scribd
You are on page 1of 9
UV-VIS a.
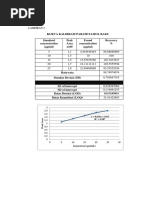
Konsentrasi 3,5 ppm
V1 . N1 = V2 . N2
1. Pembuatan Larutan Stok V1 . 500 ppm = 10 mL . 3,5 ppm
50 mg parasetamol p.a dilarutkan dalam 100 mL etanol 96% 35
V1 =
500
50 mg x = 0,07 mL = 70 µL
=
100 mL 1000 b. Konsentrasi 4 ppm
V1 . N1 = V2 . N2
50.000
x = V1 . 500 ppm = 10 mL . 4 ppm
100 40
V1 =
x = 500 ppm 500
= 0,08 mL = 80 µL
Konsentrasi
Absorbansi
Standar (ppm) c. Konsentrasi 4,5 ppm
3,5 0,34 V1 . N1 = V2 . N2
4 0,41 V1 . 500 ppm = 10 mL . 4,5 ppm
45
4,5 0,48 V1 =
500
5 0,56 = 0,09 mL = 90 µL
5,5 0,68 d. Konsentrasi 5 ppm
6 0,75 V1 . N1 = V2 . N2
V1 . 500 ppm = 10 mL . 5 ppm
6,5 0,83 50
V1 =
500
= 0,10 mL = 100 µL
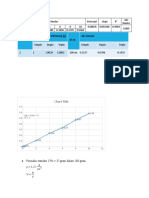
Kurva Kalibrasi Paracetamol e. Konsentrasi 5,5 ppm
1 V1 . N1 = V2 . N2
V1 . 500 ppm = 10 mL . 5,5 ppm
Absorbansi
f(x) = 0.17 x − 0.26
0.5 R² = 0.99 55
Linear () V1 =
500
0
2 3 4 5 6 7 = 1,1 mL = 110 µL
Konsentrasi (ppm)
f. Konsentrasi 6 ppm
V1 . N1 = V2 . N2
V1 . 500 ppm = 10 mL . 6 ppm
60
V1 =
500
2. Perhitungan Pengenceran = 1,2 mL = 120 µL
g. Konsentrasi 6,5 ppm
V1 . N1 = V2 . N2 IODIMETRI
V1 . 500 ppm = 10 mL . 6,5 ppm
65 Pembakuan Vitamin C dengan K2Cr2O7
V1 = Dik : K2Cr2O7 = 50 mg, BM K2Cr2O7 = 249
500
= 1,3 mL = 130 µL
Percobaan Ke- VNa2S2O3 NNa2S2O3
3. Perhitungan Kadar Sampel 1 20,6 ml 0,049 N
Diketahui : 2 20,5 ml 0,049 N
a = 0,2607 3 20,6 ml 0,049 N
b = 0,1679 Rata-rata 0,049 N
Absorbansi sampel = 0,4125 Perhitungan :
Perhitungan Persamaan Regresi Linear : 1) Mgek Na2S2O3 = Mgek K2Cr2O7
y = bx + a mg K 2 Cr 2 O7
VNa2S2O3 . NNa2S2O3 =
0,4125 = 0,01679x + 0,2607 BE K 2Cr 2O 7
0,4125- 0,2607 = 0,01679x mg K 2 Cr 2 O7
NNa2S2O3 =
x = 4,0095 BE K 2Cr 2O 7 .VNa 2 S 2 O3
50 mg
Konsentrasi = 4,0095 x factor pengenceran =
49 . 20,6 ml
NNa2S2O3 = 0,0495 N
Konsentrasi = 4,0095 x 10
mg K 2 Cr 2 O7
2) NNa2S2O3 =
Konsentrasi = 40,095 ppm BE K 2Cr 2O 7 .VNa 2 S 2 O3
50 mg
=
49 . 20,5 ml
NNa2S2O3 = 0,0497 N
mg K 2 Cr 2 O7
3) NNa2S2O3 =
BE K 2Cr 2O 7 .VNa 2 S 2 O3
50 mg
=
49 . 20,6 ml
NNa2S2O3 = 0,0495 N
Pembakuan Larutan Iodium (I2) dengan larutan Na2S2O3 (0,049 N)
Pecobaan Ke- VI VNa2S2O3 NI
1 10 ml 9,6 ml 0,047 N
2 10 ml 9,8 ml 0,048 N 11,5ml . 0,047 N
=
3 10 ml 9,7 ml 0,047 N 10 ml
Rata-rata 0,047 N NVitC = 0,054 N
Perhitungan : ¿
2) NVitC = VI .∋ VVitC ¿
1) VI . NI = VNa2S2O3 . NNa2S2O3 11,7 ml . 0,047 N
=
VNa 2 S 2 O3 . NNa 2 S 2 O3 10 ml
NI =
VI NVitC = 0,055 N
9,6 ml . 0,049 N 3) NVitC
¿
= VI .∋ VVitC ¿
=
10 ml
NI = 0,047 N 11,5ml . 0,047 N
=
VNa 2 S 2 O3 . NNa 2 S 2 O3 10 ml
2) NI = NVitC = 0,054 N
VI
9,8 ml . 0,049 N 0,054 N +0,055 N +0,054 N
= Rata-rata = = 0,054 N
10 ml 3
NI = 0,048 N
VNa 2 S 2 O3 . NNa 2 S 2 O3 g VitC = NVitC x BE VitC x VVitC
3) NI =
VI = 0,054 N x 88,065 x 0,05 L
9,7 ml . 0,049 N = 0,237 gram/50 ml
=
10 ml g VitC
NI = 0,047 N % Vit C = x 100%
VVitC
0,237 g
0,047 N +0,048 N +0,047 N = x 100%
NI rata-rata = = 0,047 N 50 ml
3
% Vit C = 0,474 %
Penetapan Kadar Analit (Vitamin C)
Pecobaan Ke- VVitC VI NVitC
1 10 ml 11,5 ml 0,054 N
2 10 ml 11,7 ml 0,055 N
3 10 ml 11,5 ml 0,054 N
Rata-rata 0,054 N
Perhitungan :
1) VVitC . NVitC = VI . NI
¿ ¿
NVitC = VI .∋ VVitC
0,048 N + 0,049 N + 0,048 N
MEDTA rata-rata = = 0,048 N
3
Titrasi Blanko
Percobaan Ke- VPelarut VEDTA MPelarut
KOMPLEKSOMETRI 1 10 ml 0,4 ml 0,002 M
2 10 ml 0,6 ml 0,003 M
Pembakuan EDTA menggunakan ZnSO4 0,05 M 3 10 ml 0,4 ml 0,002 M
Rata-rata 0,0023 M
Percobaan VNa2EDTA MNa2EDTA
Ke-
1 12,8 ml 0,048 M Perhitungan :
2 12,6 ml 0,049 M
3 12,8 ml 0,048 M 1. VPelarut . MPelarut = VEDTA . MEDTA
Rata-rata 0,048 M VEDTA . MEDTA
MPelarut1 =
Perhitungan : VPelarut
0,4 ml . 0,048 M
=
1. mmol EDTA = mmol ZnSO4 10 ml
mg ZnSO 4 MPelarut1 = 0,002 M
VEDTA . MEDTA =
Mr ZnSO 4 VEDTA . MEDTA
2. MPelarut2 =
mg ZnSO 4 VPelarut
MEDTA =
Mr ZnSO 4 . VEDTA 0,6 ml . 0,048 M
=
100 mg 10 ml
=
161. 12,8 ml
MEDTA = 0,048 M MPelarut2 = 0,003 M
mg ZnSO 4 VEDTA . MEDTA
2. MEDTA = 3. MPelarut3 =
Mr ZnSO 4 . VEDTA VPelarut
100 mg 0,4 ml . 0,048 M
= =
161. 12,6 ml 10 ml
MEDTA = 0,049 M MPelaurt3 = 0,002 M
mg ZnSO 4 0,002 M +0,003 M +0,002 M
3. MEDTA = MPelarut rata-rata = = 0,0023 M
Mr ZnSO 4 . VEDTA 3
100 mg
=
161. 12,8 ml Penetapan Kadar Analit (Asam Mefenamat) dengan Titrasi Komplesometri
Refreshment
MEDTA = 0,048 M
Percobaan VAsam VZnSO4 yang VTitrasi VEDTA VZnSO4 VZnSO4 8,7 ml . 0,048 M
=
Ke- Mefenamat ditambahka Blanko (VEDTA berlebih yang 0,05 M
n yang bereaksi VZnSO4 berlebih = 8,35 ml
bereaksi dengan
dengan analit - Menghitung VZnSO4 yang bereaksi dengan analit
ZnSO4) 1. VZnSO4 analit = VZnSO4 yang ditambahkan – Vtitrasi Blanko – VZnSO4
1 10 ml 10 ml 0,4 ml 8,8 ml 8,45 1,15 ml berlebih
ml
2 10 ml 10 ml 0,6 ml 8,7 ml 8,35 1,05 ml = 10 ml – 0,4 ml – 8,45 ml
ml VZnSO4 analit = 1,15 ml
3 10 ml 10 ml 0,4 ml 8,7 ml 8,5 ml 1,25 ml
2. VZnSO4 analit = 10 ml – 0,6 ml – 8,35 ml
= 1,05 ml
3. VZnSO4 analit = 10 ml – 0,4 ml – 8,5 ml
VZnSO4 analit = 1,25
Perhitungan :
- Menghitung VZnSO4 berlebih
1. VZnSO4 . MZnSO4 = VEDTA. MEDTA
Penetapan Kadar Asam Mefenamat menggunakan Titrasi
VEDTA . MEDTA
VZnSO4 berlebih = Kompleksometri Refrreshment
MZnSO 4 1. VAsam Mefenamat . MAsam Mefenamat = VZnSO4 . MZnSO4
8,8 ml . 0,048 M VZnSO 4 . MZnSO 4
= MAsam Mefenamat =
0,05 M VAsam Mefenamat
1,15 ml .0,05 M
=
VZnSO4 berlebih = 8,45 ml 10 ml
MAsam Mefenamat = 0,006 M
VEDTA . MEDTA
2. VZnSO4 berlebih =
MZnSO 4 VZnSO 4 . MZnSO 4
8,7 ml . 0,048 M 2. MAsam Mefenamat =
= VAsam Mefenamat
0,05 M 1,05 ml .0,05 M
VZnSO4 berlebih = 8,35 ml =
10 ml
MAsam Mefenamat = 0,005 M
VEDTA . MEDTA
3. VZnSO4 berlebih =
MZnSO 4 VZnSO 4 . MZnSO 4
3. MAsam Mefenamat =
VAsam Mefenamat
1,25 ml .0,05 M mg AsamOksalat
= 1. VNaOH . NNaOH =
10 ml BE AsamOksalat
MAsam Mefenamat = 0,006 M mg Asam Oksalat
0,006 M + 0,005 M +0,006 M NNaOH =
BE AsamOksalat . VNaOH
MAsam Mefenamat rata-rata = = 0,006 M
3 63 mg
NNaOH =
g Asam Mefenamat = MAsam Mefenamat x BM Asam Mefenamat x VAsam 63 .10 , 8 ml
Mefenamat NNaOH1 = 0,092 N
= 0,006 M x 241,29 x 0,05 L mg Asam Oksalat
2. NNaOH2 =
BE AsamOksalat . VNaOH
g Asam Mefenamat = 0,07 g 63 mg
=
g Asam Mefenamat 63 .10,5 ml
% Asam Mefenamat = x 100%
VAsam Mefenamat NNaOH2 = 0,095 N
0,07 g
= x 100%
50 ml mg Asam Oksalat
3. NNaOH3 =
BE AsamOksalat . VNaOH
% Asam Mefenamat = 0,14% b/v 63 mg
=
63 .10,6 ml
NNaOH3 = 0,094 N
0,092 N + 0,095 N +0,094 N
NNaOH rata-rata = = 0,094 N
3
Pembakuan HCl menggunakan NaOH hasil pembakuan (0,094 N)
Percobaan Ke- VNaOH VHCl NHCl
ASAM BASA TIDAK LANGSUNG 1 10 ml 10,4 ml 0,090 N
2 10 ml 10,6 ml 0,090 N
Sampel : 18 3 10 ml 10,4 ml 0,090 N
Pembakuan NaOH menggunakan Asam Oksalat 0,1 N Rata-rata 0,090 N
Percobaan Ke- VAsam Oksalat VNaOH NNaOH
Perhitungan :
1 10 ml 10, 8 ml 0,092 N
1. VHCl . NHCl = VNaOH . NNaOH
2 10 ml 10,5 ml 0,095 N
VNaOH . NNaOH
3 10 ml 10,6 ml 0,094 N NHCl1 =
VHCl 1
Rata-rata 0,094 N
10 ml . 0,094 N
Perhitungan : =
10,4 ml
Mgek NaOH = Mgek Asam Oksalat
NHCl1 = 0,090 N
VNaOH . NNaOH VHCl . NHCl
2. NHCl2 = 3. NPelarut3 =
VHCl 2 VPelarut 3
0,1 ml .0,090 N
10 ml . 0,094 N =
= 10 ml
10,6 ml NPelarut3 = 0,0009 N
NHCl2 = 0,090 N 0,0018 N + 0,0018 N + 0,0009 N
NPelarut rata-rata = = 0,0015 N
VNaOH . NNaOH 3
3. NHCl3 =
VHCl 3
10 ml . 0,094 N
=
10,4 ml Penetapan Kadar Analit (Asetosal) dengan Titrasi Asam Basa Tidak
NHCl3 = 0,090 N Langsung
0,090 N + 0,090 N + 0,090 N Percobaa VAsetosal VNaOH yang VTitrasi VHCl (VNaOH VNaOH VNaOH yang
NHCl rata – rata = = 0,090 N
3 n Ke- ditambahkan Blanko yang berlebih bereaksi
bereaksi dengan
Titrasi Blanko (Pelarut yang digunakan etanol 96%) dengan analit
Percobaan Ke- VPelarut VHCl NPelarut HCl)
1 10 ml 0,2 ml 0,0018 N 1 10 ml 25 ml 0,2 ml 20,8 ml
19,91 4,89 ml
ml
2 10 ml 0,2 ml 0,0018 N
2 10 ml 25 ml 0,2 ml 20,5 ml 19,63 5,17 ml
3 10 ml 0,1 ml 0,0009 N
ml
Rata-rata 0,0015 N
3 10 ml 25 ml 0,1 ml 20,6 ml 19,72 5,18 ml
Perhitungan :
ml
1. VPelarut . NPelarut = VHCl . NHCl
VHCl . NHCl Keterangan : VNaOH yang bereaksi dengan analit = VNaOH yang ditambahkan -
NPelarut1 = VTitrasi Blanko – VNaOH berlebih
VPelarut 1
NNaOH = 0,094 N
0,2 ml .0,090 N
=
10 ml
Perhitungan :
NPelarut1 = 0,0018 N
1. VNaOH berlebih . NNaOH = VHCl . NHCl
VHCl . NHCl
2. NPelarut2 = VHCl . NHCl
VPelarut 2 VNaOH berlebih =
NNaOH
0,2 ml .0,090 N
= 20,8 ml . 0,090 N
10 ml =
0,094 N
NPelarut2 = 0,0018 N
VNaOH berlebih = 19,91 ml
1. VAsetosal . NAsetosal = VNaOH. NNaOH
VNaOH . NNaOH berlebih g Asetosal
NAsetosal = % Asetosal = x 100%
VAsetosal VAsetosal
4,89 ml . 0,094 N 0,43 g
= = x 100%
10 ml 50 ml
NAsetosal = 0,046 N
% Asetosal = 0,86 % b/v
VHCl . NHCl
2. VNaOH berlebih =
NNaOH
20,5 ml . 0,090 N
=
0,094 N ARGENTOMETRI
VNaOH berlebih = 19,63 ml Dik : BM Tramadol HCl = 299,84
BM HCl = 36,5
VNaOH . NNaOH berlebih
2. NAsetosal = BE NaCl = 58,5
VAsetosal
Pembakuan AgNO3 dengan NaCl p.a
5,17 ml . 0,094 N
= Dik : Bobot NaCl p.a = 50 mg
10 ml
NAsetosal = 0,049 ml Percobaan Ke- VAgNO3 NAgNO3
1 17,4 ml 0,049 N
VHCl . NHCl 2 17,3 ml 0,049 N
3. VNaOH berlebih =
NNaOH
20,6 ml . 0,090 N 3 17,4 ml 0,049 N
= Rata-rata 0,049 N
0,094 N
VNaOH berlebih = 19,72 ml Perhitungan :
1) Mgek AgNO3 = Mgek NaCl
VNaOH . NNaOH berlebih mg NaCl
3. NAsetosal = VAgNO3 . NAgNO3 =
VAsetosal BE NaCl
5,18 ml .0,094 ml mg NaCl
= NAgNO3 =
10 ml BE NaCl .VAgNO 3
NAsetosal = 0,049 N 50 mg
=
58,5. 17,4 ml
0,046 N +0,049 N + 0,049 N NAgNO3 = 0,049 N
NAsetosal rata-rata = = 0,048 N
3 mg NaCl
2) NAgNO3 =
BE NaCl .VAgNO 3
g Asetosal = NAsetosal x BE Asetosal x VAsetosal 50 mg
= 0,048 N x 180,16 x 0,05 L =
58,5. 17,3 ml
g Asetosal = 0,43 g NAgNO3 = 0,049 N
mg NaCl g HCl = NHCl x BE HCl x VHCl
3) NAgNO3 =
BE NaCl .VAgNO 3 = 0,047 N x 36,5 x 0,05 L
50 mg
= g HCl = 0,086 gram
58,5. 17,4 ml
NAgNO3 = 0,049 N BM Tramadol HCl
g Tramadol HCl = x g HCl
0,049 N + 0,049 N + 0,049 N BM HCl
NAgNO3 rata-rata = = 0,049 N
3 299,84
= x 0,08 g
Penetapan Kadar Tramadol HCl dengan Titrasi Argentometri Metode Mohr 36,5
g Tramadol HCl = 0,71 g/50 ml
Percobaan Ke- VHCl VAgNO3 NHCl
1 10 ml 9,7 ml 0,048 N g Tramadol HCl
2 10 ml 9,5 ml 0,046 N % Tramadol HCl = x 100%
V Tramadol HCl
3 10 ml 9,8 ml 0,048 N
Rata-rata 0,047 N 0,71 g
= x 100%
Perhitungan : 50 ml
1) VHCl . NHCl = VAgNO3 . NAgNO3 % Tramadol HCl = 1,42 %
VAgNO3 . NAgNO 3
NHCl =
VHCl
9,7 ml . 0,049 N
=
10 ml
NHCl = 0,048 N
VAgNO3 . NAgNO 3
2) NHCl =
VHCl
9,5 ml . 0,049 N
=
10 ml
NHCl = 0,046 N
VAgNO3 . NAgNO 3
3) NHCl =
VHCl
9,8 ml . 0,049 N
=
10 ml
NHCl = 0,048 N
0,048 N + 0,046 N +0,048 N
NHCl rata-rata = = 0,047 N
3
You might also like
- RL 350 PDFDocument150 pagesRL 350 PDFBhumika89% (9)
- USP-NF Sterile Water For IrrigationDocument1 pageUSP-NF Sterile Water For IrrigationMiguel Egas LoorNo ratings yet
- Geology of Sudbury BasinDocument44 pagesGeology of Sudbury BasinburhanudinNo ratings yet
- Bomba Stanadyne John DeereDocument60 pagesBomba Stanadyne John Deereyamilmr100% (18)
- Skin Care Creams Formulation and UseDocument34 pagesSkin Care Creams Formulation and UseKarina Chumakova100% (1)
- PERHITUNGANDocument10 pagesPERHITUNGANRisnawa Puji AstutiNo ratings yet
- Perhitungan 1Document3 pagesPerhitungan 1Diah Siti FatimahNo ratings yet
- Bab 4 Hasil Dan PembahasanDocument3 pagesBab 4 Hasil Dan PembahasanM SyafNo ratings yet
- Bab Iii Hasil Dan Pembahasan 3.1 Data Pengamatan 3.1.1 Penentuan Panjang Gelombang MaksimumDocument3 pagesBab Iii Hasil Dan Pembahasan 3.1 Data Pengamatan 3.1.1 Penentuan Panjang Gelombang MaksimumFaniangginaNo ratings yet
- Perhitungan Baku AspiletDocument4 pagesPerhitungan Baku AspiletNisa Fitri RahmadianiNo ratings yet
- Lembar Perhitungan Ester p0Document10 pagesLembar Perhitungan Ester p0Zahra AlifiaNo ratings yet
- Kelompok 8 Perhitungan FormalinDocument4 pagesKelompok 8 Perhitungan FormalinJilan QfNo ratings yet
- Perhitungan Laprak Kai VisibleDocument7 pagesPerhitungan Laprak Kai VisibleWanda SariNo ratings yet
- Grafik Talia PDocument3 pagesGrafik Talia PTalia PuspayindraNo ratings yet
- Kurva Kalibrasi Parasetamol Baku Standard Concentration ( G/ML) Peak Area x105 Found Concentration ( G/ML) Recovery %Document4 pagesKurva Kalibrasi Parasetamol Baku Standard Concentration ( G/ML) Peak Area x105 Found Concentration ( G/ML) Recovery %LianNo ratings yet
- Lampiran 3Document1 pageLampiran 3Hime ChanNo ratings yet
- Bab IvDocument4 pagesBab IvEvania Putri100% (1)
- CALCULO1Document5 pagesCALCULO1daniela salamanca granadosNo ratings yet
- Perhitungan CuDocument3 pagesPerhitungan CuPutri Indah AstutiNo ratings yet
- KELOMPOK 8 - 4B - Analisis FormalinDocument11 pagesKELOMPOK 8 - 4B - Analisis FormalinLidya Evangelista TampubolonNo ratings yet
- PerhitunganDocument4 pagesPerhitunganDiane FauziNo ratings yet
- Analisis DataDocument3 pagesAnalisis DataNurlailiyah Razak DjugarangNo ratings yet
- Lampiran 2. Perhitungan A. Pembuatan Larutan IndukDocument3 pagesLampiran 2. Perhitungan A. Pembuatan Larutan IndukAnnisa LuthfiyyahNo ratings yet
- Data Pengamatan Biofar p6Document9 pagesData Pengamatan Biofar p6nuningNo ratings yet
- Contok Perhitungan Validasi LevoDocument25 pagesContok Perhitungan Validasi Levointan kusumaningtyasNo ratings yet
- LAMPIRANDocument3 pagesLAMPIRANGina Sri Nur WulanNo ratings yet
- Bab Iv.1 HasilDocument6 pagesBab Iv.1 HasilCitra KencanaNo ratings yet
- Pharmaceutical Calculations: Module 3: Practice of Pharmacy (17.5%)Document4 pagesPharmaceutical Calculations: Module 3: Practice of Pharmacy (17.5%)AnarchyNo ratings yet
- Data Perhitungan Kfa Praktikum 2Document3 pagesData Perhitungan Kfa Praktikum 2Mila AuliaNo ratings yet
- APENDIKS NitratDocument1 pageAPENDIKS NitratAigah Ameilia ManullangNo ratings yet
- Vi. Hasil Percobaan Signal Generator 50 MHZ, 0Dbm Osiloskop Int Modulasi Index Am/ Dev FM Gambar Amplitudo (VPP)Document2 pagesVi. Hasil Percobaan Signal Generator 50 MHZ, 0Dbm Osiloskop Int Modulasi Index Am/ Dev FM Gambar Amplitudo (VPP)raissssssNo ratings yet
- ConcentrationsDocument24 pagesConcentrationsmathsis thelife100% (2)
- Kelompok Bobot Sampel Ditimbang (G) Di Ad Abs SampelDocument4 pagesKelompok Bobot Sampel Ditimbang (G) Di Ad Abs SampelJilan QfNo ratings yet
- Addition StandardDocument6 pagesAddition StandardWelinda MemeNo ratings yet
- Lembar Perhitungan HDPDocument4 pagesLembar Perhitungan HDPScandyinHavia EmmuachhNo ratings yet
- To Determine % Purity of The Given Sample of Mefenamic Acid by Titrimetric Method. Chemicals RequiredDocument4 pagesTo Determine % Purity of The Given Sample of Mefenamic Acid by Titrimetric Method. Chemicals RequiredjerritNo ratings yet
- MT 1b SubtractionDocument5 pagesMT 1b SubtractionAndyKongNo ratings yet
- Formula 2018Document4 pagesFormula 2018wira484No ratings yet
- Hasil Pengamatan: Berat Kertas+zat 0,530 G Berat Kertas+sisa 0,481 G Berat Sebenarnya 0,049 GDocument5 pagesHasil Pengamatan: Berat Kertas+zat 0,530 G Berat Kertas+sisa 0,481 G Berat Sebenarnya 0,049 GRezhaJupeMotovloger areaNo ratings yet
- CH Cooc H: AppendiksDocument5 pagesCH Cooc H: AppendiksKatherine PutriNo ratings yet
- PowerPoint 2 DilutionsDocument13 pagesPowerPoint 2 DilutionsJustin HuntingNo ratings yet
- Vitamin CDocument4 pagesVitamin CCindyNo ratings yet
- Praktikum Teknologi Sediaan SterilDocument11 pagesPraktikum Teknologi Sediaan SterilAqila Idellia IndrianiNo ratings yet
- Data PengamatanDocument6 pagesData Pengamatanwortelkentang111No ratings yet
- Lampiran B Analisa Konsentrasi AbDocument4 pagesLampiran B Analisa Konsentrasi Abpahmi sariNo ratings yet
- Lampiran B Analisa Konsentrasi AbDocument4 pagesLampiran B Analisa Konsentrasi Abpahmi sariNo ratings yet
- BAB IV DexaDocument14 pagesBAB IV DexaTira UsmanNo ratings yet
- Lampiran A Hasil Perhitungan: A.1 Menghitung Membuat LarutanDocument6 pagesLampiran A Hasil Perhitungan: A.1 Menghitung Membuat Larutanmuhammad thariqNo ratings yet
- Lampiran 1. Perhitungan Dapar Fosfat: G MR X V G XDocument7 pagesLampiran 1. Perhitungan Dapar Fosfat: G MR X V G XNurul HudaNo ratings yet
- Perhitungan Larutan Standar ChlorineDocument7 pagesPerhitungan Larutan Standar ChlorineDhimas ApriyantoNo ratings yet
- Bab Iv Hasil Dan Pembahasan 4.1 Data PengamatanDocument9 pagesBab Iv Hasil Dan Pembahasan 4.1 Data PengamatanSazgiaMaudaraNo ratings yet
- Bab Iv Hasil Pengamatan: Kurva BakuDocument5 pagesBab Iv Hasil Pengamatan: Kurva BakuDela djamaludinNo ratings yet
- No Jumlah Asam Propionat (ML) Titrasi Naoh (ML) Ekstrak Rafinat 1 1 1,6 1,4 2 2 3,3 2,4 3 3 4,6 4 4 4 5,8 5,1 5 5 7,2 6,7Document6 pagesNo Jumlah Asam Propionat (ML) Titrasi Naoh (ML) Ekstrak Rafinat 1 1 1,6 1,4 2 2 3,3 2,4 3 3 4,6 4 4 4 5,8 5,1 5 5 7,2 6,7Devita UtamiNo ratings yet
- HasilDocument3 pagesHasilCindyNo ratings yet
- Perhitungan P6 YuliDocument6 pagesPerhitungan P6 YuliyuliraraNo ratings yet
- Homework 5 Breyonna MorganDocument3 pagesHomework 5 Breyonna MorganBreyonnaMorganNo ratings yet
- Mollier DiagramDocument34 pagesMollier DiagramejcaeksieNo ratings yet
- Perhitungan Dossis Chemical RO Dan ClarifierDocument29 pagesPerhitungan Dossis Chemical RO Dan ClarifierAndi LeeNo ratings yet
- CHM 260 Lab Report Exp 4Document7 pagesCHM 260 Lab Report Exp 4Warina 01No ratings yet
- MECH 410L - Lab 3Document10 pagesMECH 410L - Lab 3Ahmad El HajNo ratings yet
- A) Etanol 20%: Perhitungan 1. Perhitungan Densitas EtanolDocument7 pagesA) Etanol 20%: Perhitungan 1. Perhitungan Densitas EtanolSigit HermawanNo ratings yet
- Chem LecturesDocument8 pagesChem LecturesLovely Ann MartinNo ratings yet
- Kurva Kalibrasi Larutan Standar Tanpa Buffer: LampiranDocument3 pagesKurva Kalibrasi Larutan Standar Tanpa Buffer: LampiranAnyberta Dwi ListyantiNo ratings yet
- Para El Bicarbonato de Sodio: PH: 8,43 M: 0,5 V 50 ML N : 0,5g 84 G/molDocument2 pagesPara El Bicarbonato de Sodio: PH: 8,43 M: 0,5 V 50 ML N : 0,5g 84 G/molEsthefaniNo ratings yet
- Herbs ObafemiDocument9 pagesHerbs ObafemiJuniorErinle100% (1)
- CRIFI SRL - Sand Production PlantsDocument15 pagesCRIFI SRL - Sand Production PlantsGiacomo SimoncelliNo ratings yet
- Ic FabricationDocument31 pagesIc FabricationMukesh Nexus100% (1)
- Ammonium Hydroxide, Acs Reagent: E E E E EDocument1 pageAmmonium Hydroxide, Acs Reagent: E E E E Eantony2288No ratings yet
- 111 Lab Purity KHPDocument1 page111 Lab Purity KHPsadyaNo ratings yet
- Balancing Chemical EquationsDocument13 pagesBalancing Chemical EquationsRheamae GallegoNo ratings yet
- Surface Chemistry and CatalysisDocument302 pagesSurface Chemistry and CatalysisClaramaria RodriguezNo ratings yet
- Bhagwati Foods Training Report 2Document52 pagesBhagwati Foods Training Report 2Mohd Salman Mohsin50% (2)
- Total Synthesis of CorylidinDocument7 pagesTotal Synthesis of CorylidinHafiz Usama ImamNo ratings yet
- Chapter 2Document125 pagesChapter 2annaNo ratings yet
- How To Troubleshoot Chiller ProblemsDocument2 pagesHow To Troubleshoot Chiller ProblemsTalhaMahmoodNo ratings yet
- Nickel Chrome PlatingDocument8 pagesNickel Chrome PlatingRITWIKNo ratings yet
- ASTT - Guidelines For Horizontal DirectiDocument45 pagesASTT - Guidelines For Horizontal DirectiFerdie TolosaNo ratings yet
- Sanket Pandya TDDSDocument29 pagesSanket Pandya TDDSsktniperNo ratings yet
- Study of Industrial Waste Management: Government Polytechnic, NandedDocument21 pagesStudy of Industrial Waste Management: Government Polytechnic, Nanded725 Radhika RajdharNo ratings yet
- TLVDocument1 pageTLVPavel VicentiuNo ratings yet
- Abnt NBR 15514Document20 pagesAbnt NBR 15514Andre alexander dos santosNo ratings yet
- Grinder (Small)Document2 pagesGrinder (Small)Farooq MohammadNo ratings yet
- Isc Class 12 March20 Chemistry Question Paper Solutions 2023Document14 pagesIsc Class 12 March20 Chemistry Question Paper Solutions 2023Jerusha PahanNo ratings yet
- Interbond 808: Epoxy AnticorrosiveDocument4 pagesInterbond 808: Epoxy AnticorrosivedcsamaraweeraNo ratings yet
- Aisi Cold FormedDocument53 pagesAisi Cold FormedDJ BartraNo ratings yet
- Moldova Slides 5Document12 pagesMoldova Slides 5Igor GîdeiNo ratings yet
- Especificaciones Vinil Polyflor Mystique PP Oct 2013Document1 pageEspecificaciones Vinil Polyflor Mystique PP Oct 2013Henry ValenciaNo ratings yet
- Workshop Hall HeroultDocument42 pagesWorkshop Hall HeroultGleys Kasih Deborah JuntakNo ratings yet
- MR DRY195-v3Document3 pagesMR DRY195-v3Ankita Baban GavadeNo ratings yet