Professional Documents
Culture Documents
Enzýmy
Uploaded by
Veronika Travellinglover0 ratings0% found this document useful (0 votes)
56 views3 pagesOriginal Title
enzýmy
Copyright
© © All Rights Reserved
Available Formats
DOCX, PDF, TXT or read online from Scribd
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
© All Rights Reserved
Available Formats
Download as DOCX, PDF, TXT or read online from Scribd
0 ratings0% found this document useful (0 votes)
56 views3 pagesEnzýmy
Uploaded by
Veronika TravellingloverCopyright:
© All Rights Reserved
Available Formats
Download as DOCX, PDF, TXT or read online from Scribd
You are on page 1of 3
Enzýmy
- Enzýmy sú biokatalyzátory, ktoré v živých organizmoch urýchľujú premenu určitých látok na
produkty.
Rozdiely oproti bežným chemickým katalyzátorom:
1.) rýchlosť reakcií, ktoré katalyzujú enzýmy, je niekoľkonásobne vyššia
2.) reakcie, ktoré katalyzujú enzýmy, prebiehajú za fyziologických podmienok (teploty do 50ºC,
konštantný tlak, takmer neutrálne pH)
3.) enzýmy sú omnoho špecifickejšie k substrátom
4.) nevznikajú vedľajšie produkty
5.) enzýmové reakcie môžu byť regulované
Zloženie a štruktúra enzýmov
- enzýmy sú látky bielkovinovej povahy
štruktúra enzýmov:
a,) jednoduchá
b.) viaceré podjednotky
rozdelenie enzýmov na základe chemického zloženia:
a.) jednozložkové – len bielkovina (apoenzým)
b.) dvojzložkové – bielkovina + nebielkovinová zložka (kofaktor)
Apoeným + Kofaktor → HOLOENZÝM
Bielkovinová zložka nebielkovinová zložka funkčná forma enzýmu
- kofaktor môže mať charakter:
1. anorganický charakter – ióny kovov (Fe2+, Fe3+, Cu2+,...)
2. organický charakter: a.) slabo viazaná s bielkovinou – koenzým (napr. derivty vitamínov)
b.) pevne viazaná s bielkovinou – prostetická skupina
Aktívne miesto enzýmu
- miesto na povrchu enzýmu, na ktoré sa počas katalytického procesu viaže substrát, sa nazýva aktívne
miesto
- aktívne miesto má tvar malej dutinky
- substrát a enzým do seba zapadnú ako kľúč do zámky
Špecifita enzýmovej katalýzy
Rozlišujeme dve stránky enzýmovej špecifity:
1. substrátová špecifita
- enzým katalyzuje iba premenu určitého typu substrátu (napr. len bielkoviny alebo len
tukov); niektoré sú prísne špecifické (napr. len premena konkrétnej zlúčeniny)
zodpovedná je bielkovinová časť
2. špecifita účinku
- enzým katalyzuje iba konkrétny typ premeny (napr. iba oxidácie,...)
- zabezpečuje koenzým
Enzýmy reakcie nielen urýchľujú, ale aj regulujú.
Mechanizmus reakcií
- podstata účinku je zníženie aktivačnej energie (minimálna energia potrebná na priebeh reakcie)
1. vznik enzým-substrátového komplexu
3. vznikne komplex enzým-produkt
4. komplex sa rýchlo rozpadne
5. z aktívneho miesta enzýmu sa uvoľnia produkty
Faktory ovplyvňujúce proces enzýmovej katalýzy
- rýchlosť enzýmových reakcií závisí od nasledujúcich podmienok:
a) množstvo substrátu – jeho zvyšovaním urýchlime reakciu, ak je dostatok enzýmu
b) množstvo enzýmu – jeho zvyšovaním urýchlime reakciu, ak je dostatok substrátu
c) pH prostredia – jeho vplyv závisí od konkrétnej enzýmovej reakcie (napr. pepsín funguje najlepšie pri
pH 1 až 2
d) teplota prostredia – jej znižovaním aktivita enzýmu klesá (využitie pri skladovaní potravín), jej
zvyšovaním asi do 45 °C aktivita enzýmu stúpa, pri vyšších teplotách aktivita enzýmu klesá, môže nastať ich
denaturácia
e) prítomnosť katalyzátora alebo inhibítora
Aktivácia a inhibícia enzýmov
1. Aktivácia enzýmov - zrýchľovanie účinku enzýmov
- Látky zvyšujúce katalytickú účinnosť enzýmov nazývame aktivátory (katióny kovov Mn2+ , Mg2+, Ca2+)
2. inhibícia enzýmov - spomaľovanie účinku enzýmov môže byť:
a.) kompetitívna (konkurenčná): inhibítor má podobné zloženie ako substrát a dochádza súťaženiu
substrátu a inhibítora o aktívne miesta enzýmov
- je to vratný dej, môžeme ju potlačiť zvýšením koncentrácie substrátu
b.) nekompetitívna (nekonkurenčná): inhibítor sa viaže na aktívne miesto enzýmu pevnou väzbou
- spôsobujú ju ióny ťažkých kovov (Hg, Pb, Cu – enzymatické katalytické jedy), - nevratný dej
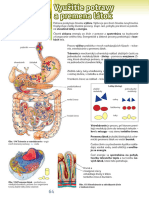
Tráviace enzýmy
- podieľajú sa na spracovaní prijatej potravy (napr. amyláza, pepsín, trypsín, lipázy,...)
amyláza - štiepi škrob na jednoduchšie sacharidy
- slinné žľazy a podžalúdková žľaza
- v slinách – ptyalín
pepsín- štiepi bielkoviny v žalúdku
- žalúdočná sliznica
trypsín - štiepi bielkoviny v tenkom čreve
- pakreas
lipázy - štiepenie lipidov
- tráviaca sústava, iné živočíšne tkanivá, rastliny, baktérie, huby
Enzýmy sú aj súčasťou mnohých pracích prostriedkov (rozkladajú organické nečistoty – škvrny od potravín,
krvi, ...)
You might also like
- Nervová SústavaDocument5 pagesNervová SústavaKatarína KubíkováNo ratings yet
- Heterocyklické ZlúčeninyDocument5 pagesHeterocyklické ZlúčeninyŠimon MatiašNo ratings yet
- Centrálna Nervová SústavaDocument1 pageCentrálna Nervová SústavaFrederik GornekNo ratings yet
- VI.a Skupina PSP - KyslíkDocument11 pagesVI.a Skupina PSP - KyslíkМаксим МорилякNo ratings yet
- BielkovinyDocument5 pagesBielkovinyŠimon MatiašNo ratings yet
- 2R Telové Tekutiny ČlovekaDocument4 pages2R Telové Tekutiny ČlovekaTinka BučekováNo ratings yet
- Fylogenézy Orgánových SústavDocument5 pagesFylogenézy Orgánových SústavtimeamicrosoftNo ratings yet
- Poznámky o KARBOXYLOCHDocument5 pagesPoznámky o KARBOXYLOCHOliver GromaNo ratings yet
- Príjem A Výdaj Látok BunkouDocument2 pagesPríjem A Výdaj Látok BunkouklM147No ratings yet
- Heterocyklické ZlúčeninyDocument2 pagesHeterocyklické ZlúčeninyTomáš Bodny BodnárNo ratings yet
- Všeobecná Biológia I., Skriptum, SekerkaDocument388 pagesVšeobecná Biológia I., Skriptum, SekerkaSlnieckoNo ratings yet
- p3 PrvkyDocument5 pagesp3 PrvkyEe ANo ratings yet
- Chem TEST 3Document5 pagesChem TEST 3Tímea TóthováNo ratings yet
- Prenos Energie V BunkeDocument1 pagePrenos Energie V BunkeАлександра ДонченкоNo ratings yet
- Chemická VäzbaDocument14 pagesChemická VäzbatarabanegorikNo ratings yet
- Pracovny Zosit Z OCHDocument165 pagesPracovny Zosit Z OCHibk18No ratings yet
- AtómDocument2 pagesAtómMarek JanigaNo ratings yet
- Maturitná Otázka Č 28Document12 pagesMaturitná Otázka Č 28alexandrakmoskovaNo ratings yet
- Poznámky S PrvkyDocument4 pagesPoznámky S PrvkyKristian BehunNo ratings yet
- Poznamky Chemia 2 RocnikDocument27 pagesPoznamky Chemia 2 RocnikRenátka Pleváková100% (1)
- ENZÝMYDocument2 pagesENZÝMYLaura SabolováNo ratings yet
- Sustavy Ziv. 2Document4 pagesSustavy Ziv. 2sattixNo ratings yet
- Pracovne Listy 17 III 0Document10 pagesPracovne Listy 17 III 0ivan.inzeratyNo ratings yet
- Chemická Reakcia A Chemický DejDocument6 pagesChemická Reakcia A Chemický DejIvana MajovskáNo ratings yet
- Atom Model AtomuDocument17 pagesAtom Model AtomuklM147No ratings yet
- 10 Katabolizmus Biochemicky Významných Látok - PoznamkyDocument3 pages10 Katabolizmus Biochemicky Významných Látok - PoznamkyAndrejNo ratings yet
- Poznã¡mky 2.r. - SãºstavyDocument20 pagesPoznã¡mky 2.r. - SãºstavynnendnsNo ratings yet
- Heterocyklické Zlúčeniny IIDocument17 pagesHeterocyklické Zlúčeniny IImanik212No ratings yet
- Orgány Zmyslového VnímaniaDocument4 pagesOrgány Zmyslového VnímaniaИгорь ЯнтарьNo ratings yet
- G-3 SyntaxDocument9 pagesG-3 SyntaxSamuel100% (1)
- MaturitaDocument30 pagesMaturitaEma BílikováNo ratings yet
- Chemicka Kinetika Preze SeminarDocument40 pagesChemicka Kinetika Preze SeminarAdrián Zigo DresingNo ratings yet
- Karboxylové Kyseliny: CharakteristikaDocument11 pagesKarboxylové Kyseliny: CharakteristikaАлександра Донченко100% (1)
- Aromaticke ZluceninyDocument6 pagesAromaticke ZluceninyKrištof VargaNo ratings yet
- Biologia v2Document9 pagesBiologia v2marcelNo ratings yet
- Príjem A Výdaj Látok BunkouDocument5 pagesPríjem A Výdaj Látok BunkouKatka AdamcovaNo ratings yet
- 3 BioDocument10 pages3 BioEva MitkovaNo ratings yet
- 2che - 2 (S-Prvky)Document4 pages2che - 2 (S-Prvky)Damian BódiNo ratings yet
- Pracovný List D PrvkyDocument2 pagesPracovný List D PrvkyTelesnávýchova BiológiaNo ratings yet
- Fylogenéza Krycej A Pohybovej SústavyDocument38 pagesFylogenéza Krycej A Pohybovej SústavyNika LikaNo ratings yet
- Chémia Poznámky 1.časťDocument6 pagesChémia Poznámky 1.časťNatália MalinovaNo ratings yet
- ChemiaDocument31 pagesChemiaanna šulcováNo ratings yet
- Biológia 7.ročník PDFDocument73 pagesBiológia 7.ročník PDF7chhgrfb6mNo ratings yet
- Chemická VäzbaDocument6 pagesChemická VäzbaAltuna IzeiriNo ratings yet
- Bio ZmyslyDocument3 pagesBio ZmyslyVeronika MerganicovaNo ratings yet
- Chemicka Kinetika PrezeDocument33 pagesChemicka Kinetika PrezeNika LikaNo ratings yet
- ÉteryDocument2 pagesÉteryVeronika TravellingloverNo ratings yet
- Dusíkaté Deriváty UhľovodíkovDocument15 pagesDusíkaté Deriváty UhľovodíkovRadovan MadaraNo ratings yet
- 3 - IzomériaDocument13 pages3 - IzomériaKaterina MeliškoNo ratings yet
- CLOVEK - Nervová - Sústava - PoznámkyDocument3 pagesCLOVEK - Nervová - Sústava - PoznámkyMartina HahmannováNo ratings yet
- Elektrónový Obal AtómuDocument2 pagesElektrónový Obal AtómuhahamanNo ratings yet
- Doučovák, Somatológia I Bez ObrDocument107 pagesDoučovák, Somatológia I Bez ObrAnežka SedlákováNo ratings yet
- 9Document10 pages9Kristína CabánikováNo ratings yet
- Test - Halogény, Alkalické Kovy, ŽelezoDocument1 pageTest - Halogény, Alkalické Kovy, ŽelezoDr. Apčať MichalNo ratings yet
- Rastlinná A Živočíšna BunkaDocument10 pagesRastlinná A Živočíšna Bunkalasli koikoNo ratings yet
- Všeobecné Poznatky o JazykuDocument5 pagesVšeobecné Poznatky o Jazykujade16100% (1)
- Biologia v4Document5 pagesBiologia v4marcelNo ratings yet
- Chemia UkazkaDocument13 pagesChemia UkazkaENIGMA PUBLISHINGNo ratings yet
- Opakovanie Na Maturitnú Skúšku - LiteratúraDocument4 pagesOpakovanie Na Maturitnú Skúšku - LiteratúraRichard LedeckýNo ratings yet
- ENZÝMYDocument1 pageENZÝMYLea SabolovaNo ratings yet