Professional Documents
Culture Documents
Teorijska Pitanja
Uploaded by
ivana_nogalo3Original Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Teorijska Pitanja
Uploaded by
ivana_nogalo3Copyright:
Available Formats
1.
Koristei konstante disocijacije i [H
+
] napiite jednadbe za najviu o vrijednost za
sljedee slabe kiseline kao ligande: a) octena (HA); b) vinska (H
2
A); c)fosforna (H
3
A).
HA A
-
+ H
+
K
1
=
[
][
]
[]
c(HA) = [HA] + [A
-
] => [A-] = o c(HA)
c(HA) =
[
+ o c(HA) /
K
1
= o|H+| + K
1
o => o =
]
Na isti nain se rjeava H
2
A i H
3
A, samo to je ukljueno vie konstanti.
2. Indikator metil-oran mijenja boju u podruju pH od 3,4 do 4,8. Odredite konstantu
navedenog indikatora. Za koji tip kiselinsko-bazne titracije biste upotrijebili ovaj
indikator? Objasnite odgovor.
pH = 3,4 1,4 => 1,4 =
[H3O+] = Ka
[]
[
]
10
-3,4
= Ka
[
]
[
]
=> K
ind
=
= 2,84 10
-4
Za titraciju prvog stupnja slabe poliprotonske kiseline jakom bazom. U takvoj titraciji
nastaje kisela sol oblika MHA iji je pH u rasponu promjene boje metilorana
(primjer, titracija prvog stupnja H
3
PO
4
s NaOH)
3. Odreivanje klorida Mohrovom metodom temelji se na titraciji analita srebrovim
nitratom uz dodatak natrijeva kromata kao indikatora. Dodatkom standardne otopine
AgNO
3
dolazi do taloenja bijelog AgCl i crvenog Ag
2
CrO
4
. Kako kapne AgNO
3
, dok
ima slobodnih Cl
-
iona nastali Ag
2
CrO
4
se otopi nakon mijeanja. Toka ekvivalencije
se postie kada crvena boja postane trajna. Objasnite zato dolazi do otapanja
Ag
2
CrO
4
Napiite konstantu ravnotee za reakciju:
Do otapanja dolazi zbog toga to je konstanta produkta topljivosti srebroga karbonata
vea od Kpt srebrovog klorida. To odreuje da je srebrov kromat topljiviji od
srebrovog klorida, tako da kad se istaloi sav AgCl jo nije dolo do taloenja
srebrova kromata, nego do taloenja dolazi kada se u otopinu doda suviak srebrovih
iona (nakon toke ekvivalencije, odnosno nakon taloenja cijelog AgCl-a).
4. Objasnite kako taloenje iz homogene otopine utjee na veliinu i istou taloga.
Navedeite primjer.
Taloenje iz homogene otopine pospjeuje dobivanje veeg, kristalinog taloga i taj
talog openito bude ii od taloga dobivenog izravnim taloenjem. To je zbog toga
to se taloni reagens stvara nekom sporom kemijskom reakcijom (hidrolizom) u
otopini uzorka, tako da se homogeno pojavljuje u cijeloj otopini i odmah reagira s
analitom. Taloenje ide sporije i potpunije. Primjer; urea kao izvor OH
-
iona.
(NH
2
)
2
CO + 3H
2
O 2NH
4
+
+ OH
-
+ CO
2
5. Je li otopina NaHCO
3
kisela ili lunata? Izvedite izraz kojim moete objasniti
odgovor. K
1
H
2
CO
3
= 4,4 10
-7;
; K
1
H
2
CO
3
= 4,7 10
-11
Vodena otopina natrijeva hidrogen-karbonata je lunata. Konstanta reakcije hidrolize
kojoj je podloan NaHCO3 je vea od konstante disocijacije (2) ugljine kiseline,
stoga u otopini prevladavaju OH
-
ioni. Izvod koji se mora napisati jest izvod za kisele
soli. Rezultat je: [H
+
] =
6. Napiite uravnoteenu ionsku jednadbu koja pokazuje: a) zato se gubi ruiasta koja
oznaava zavretak titracije kalijevim permanganatom; b) zato dolazi do stvaranja
smeeg prstena na povrini otopine KMnO
4
koja stoji u bireti vie od tri sata.
a) MnO4
-
+ 8H
+
+ 5e
-
Mn
2+
+ 4H
2
O
b) MnO
4
-
+ 2H
2
O + 3e
-
MnO
2
+ 4OH-
7. Napiite uvjetnu konstantu nastajanja, koristei konstantu nastajanja,o vrijednosti i
koncentracije jedinki za 1:1 kompleks Fe(III) sa a) acetatom {Ac
-
}; b) tartaratom
{Tar
2-
}; c) fosfatom (PO
4
3-
}.
Izvod
8. Kod odvajanja barija kao barijeva sulfata u prisutnosti malih koliina olova dolazi do
taloenja BaSO
4
koji je oneien olovljevim ionima okludiranim u reetku barijeva
sulfata. Diskutirajte ovaj oblik oneienja i objasnite zato reprecipitacija nee dati
znaajnije ii talog. K
sol
BaSO
4
= 1,110
-10
; K
sol
PbSO
4
= 1,710
-8
Takav oblik oneienja naziva se okluzija, a karakterizira je da prilikom rasta nekog
kristala, strani ion (neistoa) uraste u upljine u kristalnoj reetki kristala.
Reprecipitacija ne daje znaajnije ii talog zbog toga to se kristalini talozi koji
sadre okludirane estice u kristalnoj reetki kristala ne mogu proistiti na taj
nain. Reprecipitacija se koristi za proiavanje taloga s velikom adsorpcijskom moi
(koristi se za micanje neistoa s povrine taloga).
9. Skicirajte titracijsku krivulju polifunkcionalne baze B sa standardnom otopinom HCl
te izvedite izraz za izraunavanje kiselosti u tokama ekvivalencije.
Krivulja koja ima vidljive dvije toke ekvivalencije a kree od vieg pH prema niem.
Ima dvije toke pregiba. Izraz za izraunavanje kiselosti rauna se preko izraza za
kisele soli: [H
+
] =
10. Kako biste uporabom standardne otopine tiosulfata odredili koncentraciju slijedeih
iona MnO
4
-
; Cu
2+
; Cr
2
O
7
2-
. Objasnite osnovni princip metode i napiite odgovarajue
jednadbe kemijskih reakcija koje se dogaaju tijekom analize.
Otopinu MnO
4
-
zakiselimo s H
2
SO
4
i titriramo s standardnom otopinom tiosulfata do
promjene boje permanganata iz ruiaste u bezbojnu. Permanganat je jak oksidans i
oksidira tiosulfat do tetratioonata, a on se reducir do mangana(II).
U otopinu bakrovih(II) iona dodao bih odreen volumen otopine jodidnih iona, tono
poznate koncentracije u suviku. Bakrovi ioni bi s jodidnim ionima dali teko topljiv
talog CuI, a izlueni jod bi titrirao sa standardnom otopinom tiosulfata. Preko
stehiometrije reakcije bi se izraunala mnoina dobivenog joda, a preko nje mnoina
bakra.
U otopinu dikromata, doda se odreeni volumen jodidnih iona. Dikromat se reducir
do kroma(III) a jodidni ioni se oksidiraju do elementarnog joda. Jod se titrira sa
standardnom otopinom tiosulfata. Preko stehiometrije reakcije se izrauna mnoina
izluenog joda, a preko nje mnoina dikromata.
11. to su amfiprotina otapala? to utjee na potpunost kiselo-baznih reakcija u takvim
otapalima?
Amfiprotina otapala su otapala koja se u prisutnosti kiseline ponaaju kao baze, a u
prisutnosti base kao kiseline. Podlona su autoprotolizi (disocijaciji). Potpunost
kiselo-baznih reakcija ovisi prvenstveno o konstanti autoprotolize (mora biti to
manja), dielektrinoj konstanti (to vea), proton donorsko-akceptorskim svojstvima
otapala i topljivosti uzorka u takvom otapalu.
12. Objasnite mehanizam nastajanja taloga. Navedite i objasnite postupke kojima se moe
pospjeiti koagulacija koloidnih suspenzija?
Mehanizam nastajanja taloga ukljuuje dva bitna tipa. To su nukleacija i rast estica.
Nukleacija je pojava kada se vie manjih iona/molekula/atoma spoje i tvore vrstu,
stabilnu tvar (primer; nastajanje taloga AgCl). Rast estica je pojava kada se na
povrini postojeih jezgri (kristala) javlja rast novih estica (najee je vidljiv kod
kristalinih taloga).
13. to je hidroliza? Koji ioni hidroliziraju i kako hidroliza utjee na pH vodenih otopina
soli. Navedite kemijske reakcije.
Hidroliza je reakcija vode s ionima otopljene soli pri emu nastaju kiseline/baze. Ioni
podloni hidrolizi jesu kiselinski/bazini ostaci slabih kiselina/baza. Otopina soli moe
imati pH=7, pH>7 te pH< 7. Soli koje imaju pH<7 jesu kisele, a razlog tomu je
hidroliza iona soli, koji potjee od slabe baze. Na primjer:
NH
4
Cl NH4
+
+ Cl
-
U hidrolizu stupa NH4
+
ion dajui amonijak (bazu) i oksonijeve ione kao produkte.
Upravo su oksonijevi ioni razlozi kiselosti te otopine.
(Isto objanjenje za pH> i = 7).
14. Zato je potrebno sniziti redoks potencijal sustava MnO
4
-
/Mn
2+
kod titracije eljeza u
kloridno kiseloj otopini sa standardnom otopinom KMnO
4
? Objasnite kako se to
postie?
Redoks potencijal je potrebno sniziti zbog toga to bi permanganatni ioni mogli
oksidirati kloridne ione do elementarnog klora, ime se mijenja koncentracija prisutne
klorovodine kiseline pa analiza ne moe dati vjerodostojne rezultate. To se postie
dodavanjem preventivne otopine po Zimermann-Reinhardtu ili isparavanjem HCl-a s
sumpornom kiselinom. Preventivna otopina se sastoji od sumporne i fosforne kiseline
te manganova sulfata. Sumporna kiselina osigurava kiselost otopine koja je potrebna
pri redoks titracijama s permanganatnim ionom, fosforna kiselina vee eljezov ion u
stabilni kompleks, dok manganovi(II) ioni smanjuju koncentraciju permanganatnih
iona ime se smanjuje elektrodni potencijal.
E = E(MnO
4
-
/Mn
2+
)
[]
[][]
15. Navedite primjer indikatora koji se koristi za kompleksometrijsko odreivanje metala
s EDTA. Objasnite njegovo djelovanje.
Eriokromcrno-T. Kompleksometrijski indikatori imaju svoju karakteristinu boju koja
se javlja kod njihovog slobodnog oblika. Indikator, kada doe u dodir s metalnim
ionom vee metalni ion u stabilni kompleks, koji pak ima svoju karakteristinu boju.
Takav kompleks je stabilan, no metalni ion tvori stabilniji kompleks s kompleksonom
III. Prilikom dodavanja kompleksona u otopinu, metalni ion postepeno prelazi iz
kompleksa s indikatorom u stabilniji kompleksonat. U trenutku kada metalni ion u
potpunosti pree iz kompleksa indikatora u kompleksonat, indikator mijenja boju u
karakteristinu boju za slobodan oblik indikatora. U tom trenutku je vidljiva toka
zavretka titracije.
16. Koje uvjete mora zadovoljavati idealan taloni reagens? Objasnite kojim postupcima
se moe pospjeiti koagulacija koloidnih suspenzija?
Idealan taloni reagens mora kvantitativno reagirati s uzorkom, dajui talog koj je
slabo topljiv, koji se lagano filtrira i ispire, koji ne reagira s sastojcima atmosfere te
nakon arenja i suenja treba imati tono odreen sastav. Koagulacija se moe
pospjeiti dodavanjem odreenog elektrolita koji e umanjiti odbojne elektrostatske
sile meu koloidnim esticama, a moe se pospjeiti i digeriranjem- ostavljanje taloga
due vremena pri povienoj temperaturi u matinici uz mijeanje.
17. Koja od navedenih soli se bolje otapa u otopini amonijaka koncentracije 0,1 mol dm
-3
nego u vodi: a) Na
2
CO
3
; b) KCl; c) AgBr; d) KNO
3
; e) niti jedna? Objasnite odgovor.
Toan odgovor je pod c). Bolje se otapa srebrov bromid jer u amonijaku srebrovi ioni
tvore diaminsrebrov(I) kompleks koji je topljiv u vodi, dok je vrsti srebrov bromid u
vodi jako ne topljiva tvar.
AgBr(s) + 2NH3(aq) [Ag(NH3)2]
+
(aq) + Br
-
(aq)
18. Objasnite zato Volhardova metoda kod odreivanja jodida ima manje koraka nego
kod odreivanja karbonata? K
AgI
=8,310
-17
; KAg
2
CO
3
=8,110
-12
; K
AgSCN
=
1,110
-12
U Volhardovoj metodi halogenidi se odreuju indirektno na nain da se doda suviak
srebrovih iona u otopinu halogenidnih aniona, a suviak srebra se titrira standardnom
otopinom tiocianata. Srebrov jodid ima manju topljivost od srebrova tiocianata (vidi
Kpt). U tom sluaju- kada se odreuju jodidi, dodatkom suvika srebrova iona istaloe
se svi jodidi, a poto je topljivost tiocianata vea od topljivosti srebra, suviak
srebrovih iona se moe titrirati u istoj otopini standardnom otopinom tiocianata uz
neki eljezov(III) spoj kao indikator. Topljivost srebrova jodida je premala da bi se
otopio u vodi i uzrokovao pogreku.
Prilikom odreivanja karbonata pojavljuju se potekoe jer je produkt topljivosti
srebrova karbonata vei od produkta topljivosti srebrova tiocianata to govori da je
srebrov karbonat topljiviji od srebrova tiocianata. U tom sluaju, nakon taloenja
srebrova karbonata jedan se dio taloga otopi te je prisutan u otopini u obliku
karbonatnih i srebrovih iona. Prilikom retitracije suvika srebrovih iona tiocianatom,
moe doi do reakcije zamjene u otopini:
Ag
2
CO
3
(aq) + 2SCN
-
(aq) 2AgSCN(s) + CO
3
2-
(aq)
Ta reakcija uzrokuje pogreku u analizi zbog toga to u talog srebrova tiocianata
prelaze ioni srebra iz ve istaloenog karbonata i oni koji su ostali u suviku
(tiocianatom bi trebali odrediti samo srebrove ione u suviku). Zbog toga talog
srebrova karbonata treba filtriranjem izdvojiti iz otopine, a suviak srebra titrirati u
drugoj tikvici.
19. Bubreni kamenci, koji nastaju u mokranom traktu pri povienoj koncentracija nekih
tvari u mokrai, najee su graeni od kalcijevih i oksalatnih iona. Zato se
pacijentima koji imaju bubrene kamence a) daju preparati koji sadre magnezijeve
ione; b) preporua uzimanje veih koliina vode? Topljivost CaC
2
O
4
u urinu je 910
-5
mol dm
-3
; MgC
2
O
4
9,310
-3
mol dm
-3
; pH urina 5,9; koncentracija kalcija u urinu 510
-3
mol
dm
-3
.
Iz danih vrijednosti topljivosti Ca i Mg-oksalata vidimo da je topljivost Mg-oksalata vea od
topljivosti Ca-oksalata. Davanjem preparata koji sadre magnezijeve ione i uzimanjem veih
koliina tekuine poveava se topljivost bubrenih kamenaca. Razlog tomu je vea topljivost
Mg-oksalata od Ca-oksalata pri viim vrijednostima pH. Ravnotena koncentracija oksalatnog
iona u otopini moe se prikazati:
[C
2
0
4
2-
] =
]
.
Iz tog izraza je vidljivo slijedee: kada smanjimo koncentraciju [H
+
] iona u otopini
(razrjeujemo otopinu kad pijemo puno vode i poveavamo pH) poveavamo
koncentraciju oksalata u otopini (analogno- poveavamo topljivost kamenca). Jo kad
k tome u organizam unesemo magnezijeve ione koji tvore oksalat puno topljiviji od
kalcijeva oksalata topljivost se naglo povea i pacijent ne treba na operaciju.
20. Koji konjugirani kiselinsko-bazni parovi su prisutni i koji je njihov odnos kod pH=6 u
otopini: a) vinske kiseline (H
2
T); b) limunske kiseline (H
3
C)?
K1(H2T)=9,210
-4
; K2(H2T)=4,310
-5
; K
1
H
3
C=7,4510
-4
; K
2
H
3
C=1,7310
-5
;
K
1
H
3
C=4,0210
-7
Prvom disocijacijom H
2
T nastanu HAT
-
i H
+
. Kada se napie prva konstanta
disocijacije te kad se uvrsti vrijednost [H+] = 10
-6
, dobije se da je:
[
]
[]
]
Drugom disocijacijom nastanu H+ i T2-. Analognim uvrtavanjem [H+] = 10
-6
i druge
konstante disocijacije, dobije se:
[
]
[
]
Kombinacijom prve i druge konstante ravnotee dobijemo izraz:
[
]
[]
Kada se uvrste vrijednosti za [H+] = 10
-6
, K1 i K2, dobije se odnos [T
2-
] 9 [H
2
A]
Analogno se rijei za H3C, samo to su u igri tri konstante disocijacije.
21. to su puferi i koje je njihovo svojstvo? Na primjeru amonijanog pufera objasnite
to se dogaa dodatkom male koliine jake baze ili kiseline.
Puferi su otopine koje se sastoje od slabe kiseline i njezine soli, a odupiru se
znaajnijoj promjeni pH otopine prilikom dodatka jake kiseline/baze. Amonijani
pufer je otopina koja se sastoji od otopine amonijaka i amonijevog klorida. Ravnotea
se moe prikazati ovako:
NH
3
+ H
2
O NH
4
+
+ OH
-
i NH
4
Cl NH
4
+ + Cl-
Zbog dodatka NH4+ iona u obliku amonijeva klorida, koncentracija amonijaka je
jednaka poetnoj koncentraciji (amonijev ion po Le Chatelierovom principu sprjeava
disocijaciju amonijaka), a koncentracija soli je jednaka poetnoj koncentraciji (sol u
potpunosti disocira).
[
Dodatak jake kiseline u takav sustav ne mijenja znaajno pH sustava jer s kiselinom
reagira bazini dio pufera (amonijak) dajui vodu i sol koja je ve prisutna u otopini.
Analogno tome, dodatak jake baze ne mijenja znaajno pH sustava jer s bazom reagira
kiseli dio pufera (amonijev ion) dajui amonijak i vodu koji su ve prisutni u sustavu.
Dodatkom kiseline, koncentracija baze se smanji za koncentraciju dodane kiseline, a
koncentracija soli se povea za tu koncentraciju, dok se dodatkom baze koncentracija
baze povea za koncentraciju dodane baze, a koncentracija soli se smanji.
22. Nacrtajte krivulju titracije za odreivanje reducensa sa standardnom otopinom
oksidansa. Navedite najvanije standardne otopine oksidanse.
Krivulja izgleda slino kao i krivulja titracije jake kiseline jakom bazom. Krivulja
poinje od niih vrijednosti elektrodnih potencijala (reducensi imaju niske vrijednosti
E) prema viim vrijednostima. Ona je simetrina, ako titrans i analit reagiraju u
odnosu 1:1. Najvanije standardne otopine oskidansi su: otopina kalijeva
permanganata, kalijeva dikromata, otopine cerijevih(IV) soli.
23. Navedite primjer gdje se nekvantitativna reakcija promjenom elektrodnog
potencijala moe uiniti kvantitativnom.
Nekvantitativna reakcija jest permangantometrija u solno kiseloj otopini. Zbog
oksidacije Cl
-
iona u elementarni klor stvara se pogreka. Ako se potencijal smanji
(dodatkom preventivne otopine ili sumporne kiseline koja istiskuje klorovodik iz
otopine) potencijal se smanjuje i reakcija postane kvantitativno.
24. Ukratko objasnite mehanizam stvaranja kompleksa metala sa kompleksonom III. Na
osnovi toga objasnite nain indiciranja toke ekvivalencije
EDTA sa svim kationima metala (izuzev alkalijskih) stvara vrlo stabilne komplekse.
EDTA je polidentatni ligand jer ima 6 moguih kompleksirajuih mjesta u molekuli
(dva duika i 4 karboksilne skupine) te sa svim kationima reagira u odnosu 1:1 bez
obzira na naboj metala. Sa metalima tvori izuzetno stabilne kompleksne spojeve tzv.
kelate- kompleksne spojeve koji nalikuju prstenastim strukturama. Pri stvaranju
kompleksa dolazi do okruivanja metalnog kationa s molekulom EDTA i njegovom
izolacijom od molekula otapala.
25. Kakvu promjenu pH e izazvati dodatak a) kalijeva acetata u otopinu octene kiseline;
b) amonijeva nitrata u otopinu amonijaka; c) natrijeva formijata u otopinu mravlje
kiseline; d) kalijeva klorida u otopinu kloridne kiseline; e) barijeva jodida u otopinu
jodidne kiseline? Objasnite odgovor.
a) Kako je kalijev acetat sol jake baze i slabe kiseline hidrolizom nastaju OH- ioni
koji poveavaju pH prilikom dodatka u otopinu octane kiseline.
b) Kako je amonijev nitrat sol slabe baze i jake kiseline hidrolizom nastaju oksonijevi
ioni koji smanjuju pH otopine amonijaka.
c) Vidi pod a)
d) Poveava pH zbog toga to se dodatkom Cl
-
iona ravnotea pomakne prema
nastajanju kloridne kiseline (Le Chatelierov princip) pa se [H
+
] smanji
26. Volhardova metoda se preporuuje za analizu insekticida heptaklora C
10
H
5
Cl
7
. Maseni
udio heptaklora se rauna prema sljedeoj jednadbi:
uzorka masa
3 , 373 ) c v c v (
) heptaklor (
SCN SCN Ag Ag
= e
to navedeni raun govori o stehiometriji
navedene titracije? Objasnite odgovor.
Raun govori da je stehiometrija reakcije 1:1. Mnoina heptaklora je razlika ukupne
mnoine dodanog Ag+ iona i suvika Ag+ iona titriranog s tiocianatom. Kako je
stehiometrija reakcije srebra(I) s tiocianatom 1:1, mnoina tiocianata je jednaka
mnoini suvika srebrovih(I) iona. Kada se od ukupne mnoine dodanih srebro(I) iona
oduzme suviak i pomnoi s molarnom masom heptaklora, dobije se masa heptaklora
a dijeljenjem s ukupnom masom uzorka dobijemo maseni udio.
27. Objasnite to je peptizacija i kako se moe izbjei. Navedite primjer.
Peptizacija je proces u kojem se koagulirani talog vraa natrag u disperzno stanje. Ona
se najee dogaa prilikom ispiranja taloga gdje se elektrolit zasluan za koagulaciju
odvoji od taloga, te se pojaaju odbojne sile koje uzrokuju razdvajanje estica i
vraanje u disperzno stanje. Peptizacija se sprjeava ispiranjem s lakohlapljivim
elektrolitima (primjerice, AgCl se ispire s razrjeenom duinom kiselinom).
28. Napiite izjednaene neto ionske jednadbe i izraze za konstante ravnotea za kiselu i
bazinu disocijaciju NaH
2
PO
4
. Kolike su brojane vrijednosti tih konstanti?
K
1
H
3
PO
4
= 7,1110
-3
; K
2
H
3
PO
4
= 6,3410
-8
; K
3
H
3
PO
4
= 4,210
-13
H
2
PO
4
-
+ H
2
O HPO
4
2-
+ H
3
O
+
K
2
HPO
4
2-
+ H
2
O PO
4
3-
+ H
3
O
+
K
3
H
2
PO
4
-
+ H
2
O H
3
PO
4
+ OH
-
Kh =
= 1,410
-12
29. Koja je razlika izmeu a) oksidirajueg i reducirajueg reagensa; b) specifinih i opih
redoks indikatora? Navedite primjer.
a) Oksidirajui reagens je onaj koji se tijekom redoks procesa reducira, a drugog
sudionika u reakciji oksidira (ima veliku mo oksidacije). Reducirajui reages je
reagens koji drugog sudionika u reakciji reducira, a sam se oksidira (ima veliku
mo redukcije).
b) Specifini redoks indikatori su tvari koje reagiraju s jednim od sudionika u redoks
procesu pri emu mijenjaju boju. Primjer: krob u otopini gdje su prisutni I
3
-
ioni
daje intenzivno plavo obojenje. Opi redoks indikatori su tvari koje reagiraju na
promjenu elektrodnog potencijala odreenog redoks sustava promjenom boje.
Jedan takav primjer je itav niz derivata fenantrolina.
30. Objasnite zato multidentatni ligandi imaju prednost pred monodentatnim ligandima
za kompleksometrijsku titraciju.
Multidentatni ligandi imaju prednost zbog toga to imaju vie kompleksirajuih mjesta
u molekuli, pa je reakcija s kationom metala bra i potpunija te se lake uoi toka
zavretka titracije, dok monodentatni ligandi reagiraju u vie stupnjeva.
31. Ako se u otopinu koja sadri NaNO
3
i KSCN doda suviak AgNO
3
a) kakav e biti
naboj na povrini koaguliranog taloga; b) to je izvor tog naboja; c) koji e ioni
prevladavati u sloju suprotno nabijenih iona?
Naboj na povrini taloga srebrova tiocianata e biti pozitivan zbog srebrovih iona koji
se nalaze u suviku- (naboj na povrini taloga odreen je ionima iz reetke kristala koji
su u suviku). U sloju suprotno nabijenih iona prevladavati e nitratni ioni.
32. Skicirajte titracijsku krivulju fosforne kiseline standardnom otopinom NaOH.
Navedite sastav titracijske smjese tijekom titracije. Koje indikatore biste mogli
upotrijebiti za navedeno odreivanje. Objasnite odgovor.
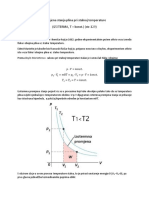
Titracijska krivulja kree od nieg pH prema viem pH i ima dvije toke
ekvivalencije. Prije dodavanja luine u otopini se nalazi fosforna kiselina (disocirani i
nedisocirani oblici). Dodatkom luine javlja se prvo pufersko podruje
H3PO4/H2PO4-. Daljnjim dodatkom luine dolazi do prve toke ekvivalencije.
Slijedeim dodatkom luine uspostavlja se pufer otopina H2PO4-/HPO42-, sve dok se
daljnjim dodavanjem luine ne doe do druge toke ekvivalencije.
U poetku bi dodao metiloran do prve toke neutralizacije, a nakon prve toke bi
dodao fenolftalein do druge toke ekvivalencije. Ta dva indikatora mijenjaju boju u
najuem interval pH unutar kojeg se nalaze prva i druga toka ekvivalencije.
33. Prema vrijednostima standardnih elektrodnih potencijala E As(V)/As(III) = +0,58V i
E
I
3
-
/I
-
= +0,54V oksidacija As(III) u As(V) otopinom joda nije mogua. Objasnite kod
kojih uvjeta se arsen moe odrediti jodimetrijski.
Arsen se moe odrediti jodimetrijski ako se povea pH otopine. Poveanjem pH
otopine (smanjenjem [H
+
]) izraz pod logaritmom se poveava, a logaritam postaje
pozitivniji to uzrokuje smanjenje elektrodnog potencijala As(V)/As(III).
Koncentracija oksonijevih iona smanji se dodatkom neke slabe luine (NaHCO
3
).
34. Definirajte i objasnite sljedee pojmove: a) relativno prezasienje; b) koprecipitacija
c) okluzija d) peptizacija.
a) Relativno prezasienje- RSS =
gdje je Q- trenutna koncentracija tvari, S-
ravnotena koncentracija tvari. Ovisno o relativnom prezasienju pri taloenju e
nastati koloidni ili kristalian talog. Ako je relativno prezasienje veliko (Q velik,
S malen) tada dominira nukleacija i nastaje koloidni talog zbog toga to se
nukleacija pri toj koncentraciji dogaa spontano. Ako je relativno prezasienje
malo (Q mali, S veliki) tada dominira rast estica i nastaje kristalini talog.
Primjer:
H2S 2H
+
+ S
2-
.
Dodatkom H+ iona ravnotea se pomie prema nastajanju sulfidne kiseline pa se
smanjuje koncentracija S
2-
iona (smanjuje se prezasienje). To odgovara stvaranju
kristalinog taloga koji je povoljniji za obradu. Kristalini e talog u ovom sluaju
nastati pri niem pH (kiseli medij).
b) Koprecipitacija (sutaloenje)- pojava pri kojoj se inae topljiva tvar izdvaja iz
otopine prilikom taloenja zajedno s talogom
c) Okluzija- vrsta oneienja koja nastane kad se prilikom rasta kristala neki strani
ion (neistoa) ugradi u upljine kristalne reetke kristala. Ne moe se proistiti
reprecipitacijom.
d) Peptizacija- pojava pri kojoj se koloidni talog prevodi natrag u disperzno stanje
(vidi 27.)
35. Kratko objasnite zato se u izrazu za konstantu ravnotee ne pojavljuje oznaka za
koncentraciju vode ili za koncentraciju vrste tvari, iako se jedna ili obje pojavljuju u
uravnoteenoj kemijskoj jednadbi.
Oznaka za koncentraciju vode ili vrste tvari se ne pojavljuje u izrazu za konstantu
ravnotee zbog toga to se pretpostavlja da je koncentracija vode ili vrste tvari puno
vea od koncentracije ostalih estica/tvari u otopini i dogovorno se uzima da je 1.
36. Objasnite zato nije mogue titrirati sva tri protona fosforne kiseline u vodenoj
otopini?
Zbog toga to je trei proton u fosfornoj kiselini toliko malo disociran da se ne moe
odrediti tona krajnja toka ekvivalencije.
37. Kada se otopina koja sadri Na
2
S
2
O
3
doda u otopinu klorovodine kiseline gotovo
trenutano dolazi do zamuenja. Napiite uravnoteenu kemijsku jednadbu koja
objanjava ovu pojavu.
O: S
2
O
3
2-
+ H
2
O SO
2
+ 2H
+
+ 4e
-
R: S
2
O
3
2-
+ 6H
+
+ 4e
-
2S + 3H
2
O
2Na
2
S
2
O
3
+ 4HCl 2SO
2
+ 2S + 2H
2
O + 4NaCl
38. Objasnite a) razliku izmeu gravimetrijske metode taloenja i gravimetrijske metode
ishlapljivanja b) to je peptizacija i kako se moe izbjei.
a) Gravimetrijska metoda taloenja se temelji na reakciji uzorka (analita) s
odreenim talonim reagensom metodom izravnog taloenja ili taloenja iz
homogene otopine pri emu nastaje teko topivi talog. Gravimetrijska metoda
ishlapljivanja se temelji na ishlapljivanju otopine (matinice) iz posude s uzorkom
pri emu na dnu zaostaje talog koji podlijee daljnjoj obradi.
b) Vidi pitanje 27.
39. to su amfiprotina otapala? Kako autoprotoliza otapala utjee na potpunost
kiselo/bazne reakcije. Napiite ravnotee i odgovarajue konstante.
Vidi pitanje 11.
40. Objasnite princip kompleksometrijskog odreivanja metala s EDTA metodom
supstitucije? Navedite primjer.
Metodom supstitucije odreuju se metalni kationi koji ne reagiraju ili sporo reagiraju s
metalokromnim indikatorom tvorei kompleks. Svrha metode je da se u otopinu
metalnog kationa doda suviak magnezijevog ili cinkovog kompleksonata. Metalni
kation tvori stabilniji kompleksonat za razliku od magnezija i cinka pa on postupno
prelazi iz otopine u kompleksonat pri emu istiskuje Mg/Zn iz tog kompleksa.
Mnoina istisnutog magnezija/cinka odreuje se titracijom standardnom otopinom
kompleksona III uz odgovarajui indikator. Vano je napomenuti da je mnoina
istisnutog metala jednaka mnoini ispitivanog metala.
41. to je gravimetrija? Koja svojstva bi trebao imati idealan taloni reagens? Objasnite
mehanizam nastajanja taloga.
Gravimetrija je kvantitativna metoda analize u kojoj se mjeri masa ispitivane tvari te
se na temelju mase tvari dobivaju traeni rezultati analize. Za svojstva talonog
reagensa vidi pitanje 15, a za mehanizam nastajanja taloga pitanje 12.
42. Napiite sve vrste koje mogu biti prisutne u otopini fosforne kiseline.Koje od
navedenih vrsta se ponaaju kao Brnstedove kiseline, koje kao Brnstedove baze a
koje i kao Brnstedove kiseline i kao Brnstedove baze? Objasnite odgovor.
U otopini fosforne kiseline prisutne mogu biti slijedee jednike:
H
3
PO
4
, H
2
PO
4
-
, HPO
4
2-
, PO
4
3-
.
Kao Brnstedove kiseline ponaaju se slijedee jedinke: H
3
PO
4
, H
2
PO
4
-
, HPO
4
2-
jer
sadre proton(e) koje(g) mogu donirati (proton donorske jedinke).
Kao Brnstedove baze ponaaju se slijedee jedinke: H
2
PO
4
-
, HPO
4
2-
, PO
4
3-
jer imaju
negativne naboje pa sadre odreeni afinitet prema protonu (proton akceptorske
jednike).
Kao kiseline i baze ponaaju se slijedee jedinke: H
2
PO
4
-
, HPO
4
2-
. One mogu biti
proton donori (kiseline) jer sadre protone koje lako otpuste, a mogu biti i proton
akceptori (baze) jer sadre negativni naboj pa imaju odreeni afinitet prema
protonima.
43. Za neku oksidacijsko/redukcijsku reakciju ukratko objasnite razliku izmeu: a)
ravnotee i ekvivalencije; b)pravog oksidacijsko/redukcijskog indikatora i specifinog
indikatora. Navedite primjere.
a) Ravnotea u redoks reakciji nastane kad su potencijali oksidacijskog i
redukcijskog sredstva jednaki. U tom stanju reakcija ne staje, ona se i dalje odvija
- koliko se jedinki oksidira, toliko se natrag reducira.
b) Za oksidacijsko/redukcijske indikatore vidi pitanje 29.
44. Odredite podruje promjene boje za Eriokrom crno T za titraciju Mg
2+
kod pH 10,0.
K
2
(H
3
In)=2,810
-12
; K
s
(MgIn
-
)=1,010
7
45. Objasnite mehanizam nastajanja taloga. Usporedite prikladnost koloidnih i
kristalininih suspenzija za gravimetrijsku analizu.
Za mehanizam nastajanja taloga vidi pitanje 12.
Koloidni talozi su talozi veliine estica od 10
-6
10
-4
mm, vrlo ih je teko, ponekad i
nemogue filtrirati, nemaju veliku tendenciju taloenja.
Kristalini talozi su talozi veliine estica od 10-2 10 mm, lako ih je filtrirati i
ispirati, lagano se taloe, ne sadre mnogo neistoa.
Iz ovog proizlazi das u kristalini talozi prihvatljiviji i prikladniji za gravimetrijsku
analizu.
46. Objasnite princip i primjenu kontroliranog taloenja sulfida u kvalitativnoj analizi kod
odjeljivanja kationa u analitike skupine.
Mnogi metalni kationi daju u vodi teko topive/ne topive sulfide. O tome da li se
pojedini sulfidi daju selektivno odvojiti ovisi o produktu topljivosti sulfida koje
elimo odvojiti, kemijskim svojstvima i pH podruju u kojem se taloe. Prije
selektivnog odvajanja potrebno je izraunati pH podruje u kojem se sulfidi taloe.
Ako se ta podruja ne poklapaju (poetak taloenja drugog sulfida je izvan pH
intervala taloenja prvog sulfida) tada je te sulfide mogue razdvojiti. Primjer je
odvajanje druge skupine kationa od etvrte skupine- sulfidi druge skupine taloe se pri
niim pH vrijednostima (veim koncentracijama [H
+
] iona) dok sulfidi etvrte skupine
kationa zaostaju u otopini i taloe se kasnije u alkalnijim otopinama. Ako je pH
podruje taloenja sulfida isto (ili se preklapaju) tada treba obratiti pozornost na
kemijska svojstva pojedinih sulfida. Na primjer, sulfidi druge skupine odvojeni su u
dvije podskupine (a i b). Sulfidi druge b) podskupine tvore s polisulfidnim anionima
komplekse u kojima se metali nalaze u viem oksidacijskom stanju te su topljivi u
vodi, dok sulfidi druge a) podskupine zaostaju u talogu.
47. Navedite vrste kiselinsko-baznih titracija ovisno o analitu. Posebno se osvrnite na
odreivanje soli slabih poliprotonskih kiselina. Nacrtajte krivulju titracije natrijeva
karbonata standardnom otopinom HCl.
Titracija slabe baze jakom kiselinom, titracija slabe kiseline jakom bazom, titracija
jake kiseline jakom bazom, titracija otopine soli slabe kiseline (mono, poliprotonske).
48. to su kiselo - bazni indikatori? to je interval promjene boje indikatora i kako se
on odreuje? Na primjeru titracije slabe baze s jakom kiselinom objasnite izbor
indikatora.
Kiselo- bazni indikatori su slabe kiseline i baze koje ovisno o koncentraciji
oksonijevih iona u otopini mijenjaju boju. Sadre svoj kiseli i bazini dio. Imaju svoju
konstantu disocijacije pomou koje se moe odrediti interval promijene boje
pojedinog indikatora.
HIn H
+
+ In
-
K
ind
=
[
][
]
[]
Interval promjene boje je pH interval unutar kojeg indikator postupno mijenja boju.
On se odreuje preko pKa vrijednosti indikatora log(K
ind
).
49. Koje se titracije ubrajaju u jodometriju a koje u jodimetriju? Na osnovi vrijednosti
standardnih potencijala nie navedenih polureakcija, objasnite uvjete pod kojima je
mogue jodimetrijsko odreivenje arsena. AsO
4
-3
+ 2H
+
+2e AsO
3
-3
+ H
2
O E
=
0,559 V I
2
(I
3
-
) + 2e 2 I
-
E
= 0,535 V
U jodimetriju se ubrajaju izravne titracije standardnom otopinom joda pri emu se
odreuju reducensi, a u jodometriju se ubrajaju titracije joda izluenog tijekom neke
reakcije sa standardnom otopinom reducensa (najee Na
2
S
2
O
3
).
Za podpitanje pogledati pitanje 33.
50. Objasnite mehanizam nastajanja taloga. Usporedite taloenje iz koloidnih i
kristalininih suspenzija.
Pitanje br. 12.
51. Objasnite princip kontroliranog taloenja hidroksida i primjenu u kvalitativnoj analizi
kod odjeljivanja kationa u analitike skupine.
Slino kao i pitanje 46. Vani podaci su pH podruje taloenja, Kpt pojedinog
hidroksida i kemijska svojstva (amfoternost u prvom planu). Pria je ista, samo
promijenite likove
52. Skicirajte krivulju titracije H
3
PO
4
standardnom otopinom NaOH. Izvedite izraz za
izraunavanje pH vrijednosti u toki ekvivalencije ako se za titraciju upotrijebi metil-
oran kao indikator.
Slika titracijske krivulje polifunkcionalne kiseline s jakom luinom (predavanja). Ako
je indikator metiloran, radi se o prvoj toki ekvivalencije (glavna tvar prisutna u
otopini je H
2
PO
4
-
. Preko izvoda za pH kiselih soli (Skoog 404.str)
[H
+
] =
53. to je gravimetrija? Opiite osnovne tipove gravimetrijskih analiza i navedite primjere
za svaki od njih.
Vidi pitanje 41.
54. Objasnite to odreuje hoe li vodena otopina soli biti kisela, bazina ili neutralna.
Pretpostavite pH otopine (>7,<7 ili ~7) koja sadri slijedee soli: a)KBr; b) Al(NO)
3
; c)
BaCl
2
; d) Bi(NO)
3
.
pH vodenih otopina soli odreen je hidrolizom iona pojedine soli. Ovisno o tome od
kakve kiseline/baze je sol graena tako e hidrolizirati.
a) Lunato
b) Kiselo
c) Neutralno (jaka baza- jaka kiselina)
d) Neutralno
55. Skicirajte krivulju titracije Na
2
CO
3
standardnom otopinom HCl. Izvedite izraz za
izraunavanje pH vrijednosti u toki ekvivalencije ako se za titraciju upotrijebi
fenolftalein kao indikator.
Slika s predavanja. Ako je indikator fenolftalein u prvoj toki ekvivalencije glavna
jedinka je HCO
3
-
. [H
+
] = .
56. Navedite koji se talozi mogu istaloiti kod optimalnih uvjeta za odreivanja fosfora
Mg- miksturom ? Kako moete kontrolom uvjeta taloenja osigurati da se istaloi
samo talog koji je najpovoljniji za odreivanje fosfora ovom metodom?
Kod optimalnih uvjeta istaloiti se mogu magnezijev dihidrogenfosfat, magnezijev
hidrogenfosfat, magnezijev fosfat i magnezijev hidroksid. Kontrolom pH vrijednosti
puferiranom otopinom postie se taloenje najpovoljnijeg taloga. Pri sobnoj
temperaturi to je MgNH
4
PO
4
6H
2
O a pri povienoj temperaturi MgNH
4
PO
4
H
2
O.
Kako su oba taloga topljiva u vodi, ispiru se razrjeenom otopinom amonijaka.
MgNH
4
PO
4
MgHPO
4
+ NH
3
57. NaHA je kisela sol budui moe dati proton. Ukratko objasnite zato se
izraunavanje pH u otopini NaHA razlikuje od rauna za slabu kiselinu tipa HA.
Izraunavanje pH u otopini NaHA se razlikuje zato to HA
-
ion, osim to moe dati
proton, moe ga i primiti; drugim rijeima HA
-
se ponaa kao kiselina i kao baza. U
obzir se moraju uzeti obje ravnotee pa se analogno tome pH rauna drugaije.
58. Kako se oksidacijsko redukcijska titracijska krivulja izvodi pomou standardnog
elektrodnog potencijala za oksidacijsko redukcijske vrste analita i volumetrijskog
titransa?
Izvodi se na nain da se uzmu tri karakteristina podruja titracije: podruje prije
toke ekvivalencije, podruje toke ekvivalencije i podruje nakon toke
ekvivalencije. U prvom podruju za raunanje potencijala uzima se ona vrsta koja je u
otopini prisutna u obliku reduciranog i oksidiranog oblika. Najee je to analit zbog
toga to je on u podruju prije toke ekvivalencije u suviku. Izraunaju se
koncentracije svake pojedine vrste i uvrste se u Nernstovu jednadbu. Potencijal u
toki ekvivalencije rauna se preko ravnotenog stanja sustava. Kako su obje vrste
(analit i titrans) u ekvivalentnom odnosu, potencijal se rauna preko izraza:
E=
Gdje su a i b broj elektrona koji sudjeluje u pojedinoj polureakciji, a E1 i E2
standardni elektrodni potencijali vrsta prisutnih u analiti/titransu.
U podruju nakon toke ekvivalencije potencijal se rauna preko vrste koja u otopini
sadri svoj oksidirani i reducirani oblik- najee je to titrans jer se on nakon toke
ekvivalencije dodaje u suviku. Nau se koncentracije svake pojedine vrste i uvrste se
u Nernstovu jednadbu.
59. Napiite kemijsku jednadbu i izraz za stupnjevite konstante nastajanja kompleksa
Ag(S
2
O
3
)
2
3-
. Objasnite koji odnos postoji izmeu stupnjevite i ukupne konstante
nastajanja.
Ag
+
+ S
2
O
3
2-
Ag(S
2
O
3
)
-
Ag(S
2
O
3
)
-
+ S
2
O
3
2-
Ag(S
2
O
3
)
3-
K
1
=
[
]
[
][
]
K
2
=
[
]
[
][
]
Ukupna konstanta nastajanja:
K
1
K
2
=
[
]
[
][
= |
60. Definirajte i na primjeru objasnite sljedee pojmove: a) digeriranje; b) relativno
prezasienje; c) peptizacija; d) elektrini dvosloj
a) Digeriranje je ostavljanje taloga u matinici due vremena pri povienoj
temperaturi u svrhu dobivanja veih estica taloga. Koristi se kod sitno kristalinih
taloga.
b) Vidi pitanje 34
c) Vidi pitanje 27
d) Elektrini dvosloj predstavlja strukturu naboja koji se stvori uz povrinu taloga
kada se nalazi u otopini elektrolita. Viak naboja na povrini taloga kompenzira se
s vikom iona suprotnog naboja prisutnog u otopini.
61. Konstanta nastajanja K
MgY
za magnezijev EDTA kompleks iznosi 510
8
. Koju pH
vrijednost biste izabrali za titraciju magnezija s EDTA, pH 5 ili pH 10? Za otopinu
EDTA kod pH = 5 o
4
= 3,510
-7
, a kod pH=10 o
4
= 3,510
-1
. Objasnite odgovor!
K = K
MgY
o
4
= 510
8
3,510
7
= 1,7510
2
K = K
MgY
o
4
= 510
8
3,510
1
= 1,7510
8
.
Konstanta nastajanja kompleksa MgY u podruju pH = 5 je premalena u odnosu na
konstantu nastajanja u podruju pH = 10. Pogodnije bi bilo podruje pH = 10.
62. Skicirajte titracijsku krivulju diprotonske kiseline H
2
A sa standardnom otopinom
NaOH te izvedite izraz za izraunavanje kiselosti u tokama ekvivalencije.
Vidi pitanje 52.
63. Objasnite razliku izmeu: a) toke ekvivalencije i zavrne toke titracije; b) pravog
redoks indikatora i specifinog indikatora za redoks titracije c) paralelnog taloenja i
sutaloenja. Navedite primjere.
a) Toka ekvivalencije je toka tijekom titracije kada su mnoine titransa i analita u
otopini jednake. Zavrna toka titracije je toka u kojoj ljudski faktor uoi
promjenu boje indikatora, pojavljivanja taloga itd..
b) Vidi pitanje 29 b)
c) Sutaloenje je proces prilikom kojeg se inae topljiva tvar izdvaja iz otopine
zajedno s talogom prilikom taloenja. Paralelno taloenje je taloenje koje se
izvodi u dvije odvojene ae u svrhu smanjivanja pogreke mjerenja.
64. Nastajanje kompleksa moe se prikazati jednadbom M + nL ML
n
, Ako je ukupna
konstanta nastajanja kompleksa |
n
, pokaite da vrijedi sljedea jednakost: log|
n
= pM
+ npL - pML
n
.
| =
[]
[][]
/ log
log| = logMLn log[M] log[L]
n
log| = - ( - log[MLn]) + p[M] + n(- log[L] )
log| = - pMLn + pM + npL
65. Kiselinsko bazni indikatori su slabe kiseline. Koju informaciju morate imati da biste
odredili u kojem pH podruju e indikator mijenjati boju? Zato neki indikatori imaju
dva odvojena pH podruja?
Da bi se pdredilo pH podruje promjene boje indikatora potrebna je konstanta
indikatora. Zato jer su po sastavu polifunkcionalne kiseline/baze ??!
66. Aluminij se gravimetrijski moe odrediti taloenjem s amonijakom ili s 8-
hidroksikinolinom (C
9
H
5
NOH). Ako analit sadri 10 mg aluminija koji biste reagens
uporabili za odreivanje sadraja aluminija u uzorku. Objasnite odgovor. (Kod
taloenja s 8-hidroksikinolinom nastaje kelat s odnosom aluminij : ligand = 1:3).
Al
3+
+ C
9
H
5
NOH Al(C
9
H
5
NO)
3
+ 3H
+
Al
3+
+ OH
-
Al(OH)
3
Upotrijebio bi se 8-hodroksikinolin zbog toga to daje talog koji ima veu molarnu
masu pa se lake i tonije moe vagati.
67. Skicirajte titracijsku krivulju otopine octane kiseline standardnom otopinom NaOH.
Koji biste indikator upotrijebili za ovu titraciju. Objasnite odgovor.
----
68. Odredite podruje promjene boje indikatora Eriokrom crno T za titraciju Ca
2+
kod pH
10,0. K
2
(H
3
In)=2,810
-12
; K
s
(CaIn
-
)=2,510
5
69. Izvedite izraz za izraunavanje elektrodnog potencijala u toki ekvivalencije za redoks
titraciju koja ne ovisi o kiselosti otopine.
E = E
1
-
log(
[]
[]
) /a
E = E
2
-
log(
[]
[]
) /b
Zbrojimo te izraze:
E (a+b) = aE
1
+ bE
2
0,059log
[][]
[][]
[A
red
] = [B
oks
] [B
red
] = [A
oks
]
E =
70. Objasnite razliku izmeu a) koprecipitacije i precipitacije; b) peptizacije i koagulacije;
c) nukleacije i rasta estica; d) koloidnog i kristalinog taloga.
a) Koprecipitacija ili sutaloenje je process pri kojemu se inae topljiva tvar izdvaja
iz otopine zajedno s talogom prilikom taloenja. Precipitacija ili taloenje je
postupak u kojem se reakcijom uzorka i talonog reagensa stvara teko topivi
talog.
b) Peptizacija je proces u kojem se talog iz koaguliranog oblika vraa natrag u
disperzno stanje. Koagulacija je process dobivanja vrste filteribilne tvari iz
koloidne suspenzije.
c) Nukleacija je proces stvaranja taloga u kojem se mali broj atoma/molekula/iona
spaja pri emu nastaje vrsta tvar. Rast estica je proces nastajanja taloga pri emu
kristal nastaje rastom na povrini ve prisutnih jezgri u otopini.
d) Koloidni talozi su talozi veliine estica od 10
-6
10
-4
mm, vrlo ih je teko,
ponekad i nemogue filtrirati, nemaju veliku tendenciju taloenja.
Kristalini talozi su talozi veliine estica od 10-2 10 mm, lako ih je filtrirati i
ispirati, lagano se taloe, ne sadre mnogo neistoa.
71. Koje su vrste prisutne u puferskom podruju kod titracije slabe baze jakom kiselinom?
Po emu se razlikuju od vrsta prisutnih u toki ekvivalencije? Razlikuju li se od vrsta
prisutnih u puferskom podruju kod titracije jake kiseline slabom bazom? Objasnite
odgovor.
72. Prema vrijednostima standardnih elektrodnih potencijala ECu
2+
/Cu
+
=+0,15V i EI
3
-
/I
-
=+0,54V Cu
2+
ne moe oksidirati jodidne ione. Objasnite zato se i kod kojih uvjeta
ipak moe bakar odrediti jodometrijski.
Elektrodni potencijal u sustavu mora biti E(Cu
2+
/Cu
+
) > E(I
3
-
/I
-
). To se moe postii
na nain da se pospjei taloenje bakrova jodida. Taloenjem se koncentracija
bakrovih(I) iona smanjuje pa elektrodni potencijal E(Cu
2+
/Cu
+
) raste. Taloenje CuI
se pospjeuje dodavanjem I- iona u otopinu, ime se koncentracija vodikovih iona
smanjuje, a pH otopine raste.
73. Objasnite princip kontroliranog taloenja hidroksida i primjenu kod selektivnih
gravimetrijskih metoda.
Vidi pitanje br. 51.
Kontroliranjem pH otopine mogue je sistematsko odjeljivanje aluminijeva i eljezova
hidroksida. Dobivaju se elatinozni talozi koji se teko filtriraju (filtriranje u vruoj
otopini). Isfiltrirane taloge potrebno je ispirati vruom otopinom amonijeva nitrata da
se sprijei peptizacija. Talozi se iare i vau kao oksidi.
74. Kratko opiite i objasnite kako biste Volhardovom metodom odredili karbonatni ion?
KAg
2
CO
3
= 8,110
-12
; KAgSCN = 1,1 10
-11
Prilikom odreivanja karbonata pojavljuju se potekoe jer je produkt topljivosti
srebrova karbonata vei od produkta topljivosti srebrova tiocianata to govori da je
srebrov karbonat topljiviji od srebrova tiocianata. U tom sluaju, nakon taloenja
srebrova karbonata jedan se dio taloga otopi te je prisutan u otopini u obliku
karbonatnih i srebrovih iona. Prilikom retitracije suvika srebrovih iona tiocianatom,
moe doi do reakcije zamjene u otopini:
Ag
2
CO
3
(aq) + 2SCN
-
(aq) 2AgSCN(s) + CO
3
2-
(aq)
Ta reakcija uzrokuje pogreku u analizi zbog toga to u talog srebrova tiocianata
prelaze ioni srebra iz ve istaloenog karbonata i oni koji su ostali u suviku
(tiocianatom bi trebali odrediti samo srebrove ione u suviku). Zbog toga talog
srebrova karbonata treba filtriranjem izdvojiti iz otopine, a suviak srebra titrirati u
drugoj tikvici.
75. Koja od sljedeih smjesa nije puferska otopina? Objasnite odgovor.
a.
100 cm
3
Na
2
CO
3
koncentracije 0,1 mol dm
-3
i 50 cm
3
HCl koncentracije 0,1
mol dm
-3
b.
100 cm
3
NaHCO
3
koncentracije 0,1 mol dm
-3
i 25 cm
3
HCl koncentracije 0,2
mol dm
-3
c.
100 cm
3
Na
2
CO
3
koncentracije 0,1 mol dm
-3
i 75 cm
3
HCl koncentracije 0,2
mol dm
-3
d.
50 cm
3
Na
2
CO
3
koncentracije 0,2 mol dm
-3
i 5 cm
3
HCl koncentracije 1,0 mol
dm
-3
e.
100 cm
3
Na
2
CO
3
koncentracije 0,1 mol dm
-3
i 50 cm
3
NaOH koncentracije 0,1
mol dm
-3
76. Opiite tri ope metode za izvoenje titracija s EDTA. Koje su prednosti svake od
njih?
Izravna titracija, neizravna titracija i metoda supstitucije.
Prednost izravne titracije je to metal brzo i potpuno reagira s kompleksonom III, a
toka zavretka titracije se moe odrediti metalokromnim indikatorom. Titracija se
izvodi na nain da se u otopinu metala doda na vrh noa metalokromnog indikatora
te se tako pripremljena otopina titrira standardnom otopinom kompleksona III, do
promjene boje.
Prednost neizravne titracije je ta to je mogue odrediti metale (katione) koji brzo i
potpuno reagiraju s kompleksonom III, ali kod kojih nije mogue odrediti toku
zavretka titracije jer nema prigodnog indikatora koji bi to indicirao. Titracija se
izvodi na nain da se u otopinu kationa doda suviak kompleksona III, a suviak se
titrira uz neku cinkovu ili magnezijevu sol uz prigodni metalokromni indikator.
Prednost metode supstitucije je to se mogu odrediti metali koji ne reagiraju ili sporo
reagiraju s metalokromnim indikatorom. Analiza se provodi na nain da se u otopinu
kationa doda suviak otopine magnezijevog ili cinkovog kompleksonata pri emu
metalni kation istiskuje magnezijeve/cinkove ione iz kompleksa. Mnoina istisnutih
magnezija / cinka odreuje se titracijom sa standardnom otopinom kompleksona III uz
indikator. .
77. to sadri preventivna otopina prema Zimmermann-Reinhard-u i kod kojih se
odreivanja mora primjeniti? Objasnite koju ulogu ima svaka pojedina tvar koju ona
sadri.
Preventivna otopina prema Zimmermann-Reinhard-u sastoji se od sumporne kiseline,
fosfatne kiseline i manganova sulfata. Primjenjuje se kod permangantometrijskih
odreivanja eljeza(II) u solno kiselim otopinama radi smanjenja potencijala
E(MnO
4
-
/Mn
2+
) radi sprjeavanja oksidacije kloridnih iona.. Sumporna kiselina
odrava kiselost otopine, fosforna kiselina vee eljezo u stabilan kompleks, a
manganovi(II) ioni smanjuju potencijal.
78. to se dogaa s vrijednou pH otopine i odnosom koncentracija puferskih
komponenata [NaA]/[HA] ako se: a) u pufer doda 0,1 mol dm
-3
NaOH; b) u pufer
doda 0,1 mol dm
-3
HCl; c) u puferu otopi isti NaA; d) u puferu otopi ista HA
79. Koja je osnovna razlika izmeu toke ekvivalencije i zavrne toke titracije? Je li se
uvijek prvo dosegne toka ekvivalencije? Objasnite odgovor i navedite primjer.
Vidi pitanje br. 63 a). Ne treba se uvijek prvo postii toka ekvivalencije- ovisi o
promjeni boje indikatora. Mogue da indikator mijenja boju u pH podruju prije toke
ekvivalencije.
80. Usporedite Fajansovu i Volhardovu metodu i obrazloite koja od njih je povoljnija za
odreivanje klorida.
Fajasnova metoda slui za odreivanje halogenida uz fluorescin kao indikator. U
ranijoj fazi titracije nastali talog AgCl-a je negativno nabijen zbog suvika Cl
-
iona u
otopini. Disocirani ioni fluorescina se odbijaju od povrine taloga jer su oni i kloridni
ioni negativnog naboja- boja otopine je zelena. Nakon toke ekvivalencije (suviak
Ag
+
iona u otopini) talog privlai Ag
+
ione pa on postaje pozitivno nabijen, to povlai
za sobom da estice taloga ponu privlaiti ione fluorescina koji se adsorbiraju na
povrinu taloga i u tom trenutku se mijenja boja otopine u crvenu to oznaava toku
zavretka titracije.
Volhardovom metodom se odreuje srebrov(I) ion u otopini, a neizravno halogenidi
standardnom otopinom tiocianata uz neku Fe(III) sol kao indikator, koja s prvim
suvikom tiocianatnih iona tvori kompleks crvene boje.
81. Objasnite razliku:a) izmeu mase i teine;b) paralelnog taloenja i sutaloenja; c)
peptizacije i koagulacije d) nukleacije i rasta estica
a) Masa je mjera tromosti tijela, a teina je sila koja djeluje na tijelo u gravitacijskom
polju.
b) Vidi pitanje 63 c)
c) Vidi pitanje 27. Koagulacija je proces u kojem se koloidne suspenzije prevode u
vrstu tvar koja se lako filtrira.
d) Nukleacija jest mehanizam nastajanja taloga u kojem se vie manjih
atoma/molekula/iona spaja dajui stabilnu vrstu tvar- karakteristina je za
koloidne taloge. Rast estica je mehanizam nastajanja taloga kod kojeg dolazi do
rasta estica na povrini ve postojeih jezgri- karakteristian je za kristaline
taloge.
82. Objasnite zato a) su polidentatni ligandi pogodniji od monodentatnih za titrimetrijska
odreivanja; b) se u otopinu u kojoj se odreuje tvrdoa vode esto dodaje mala
koliina MgY
2-
?
a) Vidi pitanje br. 30.
b) Mala koliina magnezijevog kompleksonata dodaje se u vodu samo ako ona ne
sadri magnezijeve ione, u svrhu da bi se bolje uoila promjena boje indikatora
Erioktomcrno T.
83. Slabu bazu novokain moemo simbolino prikazati kao NVK. Ako u otopinu NVK
koja ima pH 11 dodamo malu koliinu konjugirane kiseline NVKH
+
koja od sljedeih
tvrdnji je tona: a) poveava se vrijednost pH i pOH ; b) smanjuje se vrijednost pH i
pOH; c) vrijednost pH i pOH ostaje nepromijenjena; d) vrijednost pH raste a pOH
pada; e) vrijednost pH pada a pOH raste ? Objasnite odgovor.
NVK + H
2
O NVKH
+
+ OH
-
Dodavanjem konjugirane kiseline, ravnotea u otopini se pomie prema nastajanju
NVK to znai da se koncentracija OH
-
iona u otopini smanjuje, iz ega slijedi da pH
otopine pada a pOH raste.
84. U otopinu koja sadri NaNO
3
i KSCN doda se suviak AgNO
3
. a) Koji e talog
koagulirati? b) Kakav e biti naboj na njegovoj povrini? c) to je izvor tog naboja? d)
Koji ioni prevladavaju u sloju suprotno nabijenih iona? Objasnite odgovor.
Vidi pitanje br. 31.
85. Ako elite osigurati nastajanje relativno krupno zrnatog kristalinog taloga ZnS,
hoete li za taloenje odabrati uvoenje H
2
S plina u kiselu ili lunatu otopinu koja
sadri Zn
2+
ione? Objasnite.
Plin H
2
S valja uvoditi u kiselu otopinu. Kako kristalini talog nastaje mehanizmom
rasta estica, za takav talog potrebno je manje relativno prezasienje otopine.
H
2
S S
2-
+ 2H
+
Uvoenjem sumprorvodika u kiselu otopinu, ravnotea ove reakcije se pomie prema
nastajanju nedisocirane H
2
S pri emu se smanjuje koncentracija sulfidnih iona, a time
se i smanjuje relativno prezasienje otopine to rezultira stvaranjem krupno zrnatog
kristalinog taloga cinkova sulfida.
86. Napiite izraz za ukupnu uvjetnu konstantu nastajanja kompleksa Fe(C
2
O
4
)
3-
koristei
o
2
za H
2
C
2
O
4
i | vrijednost za kompleks. Izvedite izraz za izraunavanje o
2
za H
2
A.
Fe
3+
+ C
2
O
4
2-
Fe(C
2
O
4
)
+
Fe(C
2
O
4
)
+
+ C
2
O
4
2-
Fe(C
2
O
4
)
2
-
Fe(C
2
O
4
)
2
-
+ C
2
O
4
2-
Fe(C
2
O
4
)
3
3-
Napiete pojedinanu konstantu za svaki korak nastajanja i na kraju te konstante
izmnoite pa dobijete | vrijednost koja je:
K
1
K
2
K
3
= | =
[
]
[
][
o
2
=
[
| =
[
]
[
][
=> | =
[
]
[
o
3
| =
[
]
[
= K
c(H
2
A) = [H
2
A] + [HA
-
] + [A
2-
]
c(H
2
A) =
[
+
[
+ oc(H
2
A)
o =
]
87. Objasnite razliku: a) tonost-preciznost, b) medijan- srednja vrijednost, c) apsolutna i
relativna pogreka, d) sustavna i sluajna pogreka.
Tonost je slaganje mjerene vrijednosti i najvjerojatnije vrijednosti (teoretske ili prave
vrijednosti). Rezultati su toniji to su blie teoretskoj vrijednosti, iskazuje se
apsolutnom ili relativnom pogrekom. Preciznost je meusobno slaganje izmeu
rezultata mjerenja, ako su mjerenja izvedena na isti nain- izraava se devijacijom
(odstupanjem). Medijan je srednji rezultat, ako su podaci poredani po veliini ( u
neparnom broju mjerenja- srednji rezultat, u parnom broju mjerenja- aritmetika
sredina dviju vrijednosti u sredini niza rezultata). Srednja vrijednost je zbroj svih
rezultata mjerenja podijeljen s brojem izvedenih mjerenja.
Sustavne pogreke imaju tono odreen izvor koji se moe dokazati te imaju isti
predznak pri ponovljenim mjerenjima (pogreke instrumenata, pogreke metode,
ljudski faktor..). Sluajne pogreke su izvan kontrole analitiara, a manifestiraju se kao
male razlike u rezultatu izmeu vie uzastopnih mjerenja.
You might also like
- Obrazlozena Rjesenja Zadataka S Proslih Matura - Kemija 2012 JesenDocument29 pagesObrazlozena Rjesenja Zadataka S Proslih Matura - Kemija 2012 JesenIvana05No ratings yet
- 10 - Kiseline I BazeDocument19 pages10 - Kiseline I BazeGusic SalkoNo ratings yet
- TKADocument36 pagesTKAFilip BošnjakNo ratings yet
- Uvod U Kemijsku AnalizuDocument46 pagesUvod U Kemijsku AnalizumartapusNo ratings yet
- Op263a Kemija Sikirica Rijescaronenja ZadatakaDocument343 pagesOp263a Kemija Sikirica Rijescaronenja ZadatakaIva PešutNo ratings yet
- Primjeri Zadataka SpektroskopijaDocument3 pagesPrimjeri Zadataka SpektroskopijaMaja ŠtefančićNo ratings yet
- JALŠENJAKOVA Zbirka Zadataka I Riješenih Primjera Iz KemijeDocument147 pagesJALŠENJAKOVA Zbirka Zadataka I Riješenih Primjera Iz KemijeLovro PršaNo ratings yet
- Organska Kemija-Kemija Ugljikovih SpojevaDocument5 pagesOrganska Kemija-Kemija Ugljikovih SpojevaMarkoNo ratings yet
- Kemija 2Document2 pagesKemija 2Ana MilićNo ratings yet
- 5-Neutralizacijske TitracijeDocument37 pages5-Neutralizacijske TitracijeDavid IvekovićNo ratings yet
- Dodatak Za Mef ZGDocument17 pagesDodatak Za Mef ZGElla VavraNo ratings yet
- Fizikalna Kemija 2Document102 pagesFizikalna Kemija 2d-fbuser-41069129100% (1)
- Opca Kemija PredavanjaDocument103 pagesOpca Kemija PredavanjaMarko Brat Šimić50% (2)
- Osnovi Organske Hemije (BOS)Document7 pagesOsnovi Organske Hemije (BOS)Łaviç FarisNo ratings yet
- Opća Kemija-DobroDocument25 pagesOpća Kemija-DobroTihoDuman100% (1)
- 1.vrste, Svojstva I Nomenklatura Org - SpojevaDocument58 pages1.vrste, Svojstva I Nomenklatura Org - SpojevaNejraFleurNo ratings yet
- Opća Kemija 1Document19 pagesOpća Kemija 1tin švelecNo ratings yet
- Ponavljanje Za 1.PPZDocument4 pagesPonavljanje Za 1.PPZLidijaNo ratings yet
- Izotermna Promjena Stanja Idealnog PlinaDocument2 pagesIzotermna Promjena Stanja Idealnog PlinanemaNo ratings yet
- Kemija RuicDocument48 pagesKemija Ruicneeosx100% (1)
- NomenklaturaDocument20 pagesNomenklaturazelenobijelaNo ratings yet
- 2 Doseg Mjerodavni Zadaci Za VježbuDocument2 pages2 Doseg Mjerodavni Zadaci Za Vježbukarla klobucarNo ratings yet
- Org 1Document20 pagesOrg 1Iva YuiNo ratings yet
- AlkaniDocument30 pagesAlkaniMateaPerkoNo ratings yet
- Analiticka Kemija - PraktikumDocument63 pagesAnaliticka Kemija - PraktikumAna Broki50% (2)
- Opća KemijaDocument16 pagesOpća Kemija_samsaNo ratings yet
- Primjeri Zadataka Iz KinetikeDocument3 pagesPrimjeri Zadataka Iz KinetikeWriteNo ratings yet
- Anorganska Kemija PredavanjaDocument145 pagesAnorganska Kemija PredavanjaMarko MatićNo ratings yet
- Stehiom Zadaci Bez RJ S RezultatomDocument5 pagesStehiom Zadaci Bez RJ S Rezultatomsssf-dobojNo ratings yet
- TERMOKEMIJADocument2 pagesTERMOKEMIJAMagdalena GalinecNo ratings yet
- OrganskaDocument168 pagesOrganskaFotokopirnica ŠimeNo ratings yet
- 8 OtopineDocument23 pages8 OtopinesinisambNo ratings yet
- Kemija, Matura !!!Document5 pagesKemija, Matura !!!Dario TtpNo ratings yet
- OPĆA KEMIJA Za UcitDocument15 pagesOPĆA KEMIJA Za UcitMarijan DubravcicNo ratings yet
- PUFERIDocument5 pagesPUFERIfRan hOrvatNo ratings yet
- Zadaci Matura Kemija 2013Document288 pagesZadaci Matura Kemija 2013TuzlaNo ratings yet
- EStereokemija I Opticka KiralnostDocument23 pagesEStereokemija I Opticka KiralnostBedak DemirNo ratings yet
- 3 Kemijska TermodinamikaDocument44 pages3 Kemijska TermodinamikaLucijaRomićNo ratings yet
- Farmaceutski Tehničar - Analitička Kemija - Standardizacija HCL S Na2CO3 A - 2. RazredDocument14 pagesFarmaceutski Tehničar - Analitička Kemija - Standardizacija HCL S Na2CO3 A - 2. RazreddamirNo ratings yet
- Seminar Iz Analitičke Kemije 1Document152 pagesSeminar Iz Analitičke Kemije 1Josipa MićakNo ratings yet
- Zadaci KemijaDocument17 pagesZadaci KemijaNikola SiladiNo ratings yet
- Fizikalna ZadaciDocument15 pagesFizikalna Zadacianon_476820934100% (1)
- Skripta Vjezbe KemijaDocument87 pagesSkripta Vjezbe KemijaSara Kocijan100% (1)
- Analitička Kemija - 2 TestDocument3 pagesAnalitička Kemija - 2 TestMario PosavecNo ratings yet
- Taložne ReakcijeDocument37 pagesTaložne ReakcijeHrvoje Banožić100% (1)
- PT Fizikalna KemijaDocument195 pagesPT Fizikalna Kemijaigorfauxhawk100% (1)
- Zadaci Za Ponavljanje - Sastav OtopinaDocument1 pageZadaci Za Ponavljanje - Sastav OtopinaloriiNo ratings yet
- Ugljikovodici - Ponavljanje2Document9 pagesUgljikovodici - Ponavljanje2volkarthhNo ratings yet
- Ionizacija Kiselina I Njihova JakostDocument6 pagesIonizacija Kiselina I Njihova JakostmeNo ratings yet
- Ponavljanje Za Pisanu Provjeru Znanja - Kiseline, Baze, SoliDocument7 pagesPonavljanje Za Pisanu Provjeru Znanja - Kiseline, Baze, SolimightyscholarNo ratings yet
- RUDARSKO GEOLOSKI FAK. Zadaci Za Prijemni Ispit Iz HemijeDocument8 pagesRUDARSKO GEOLOSKI FAK. Zadaci Za Prijemni Ispit Iz HemijeVlada Brada MilicicNo ratings yet
- Interna Skripta Za Vjezbe Iz AKIIDocument7 pagesInterna Skripta Za Vjezbe Iz AKIIIva YuiNo ratings yet
- Zadaci Za Provjeravanje GradivaDocument5 pagesZadaci Za Provjeravanje GradivaMarkoMarkovicNo ratings yet
- Obrazlozena Rjesenja Zadataka S Proslih Matura - Kemija 2008Document24 pagesObrazlozena Rjesenja Zadataka S Proslih Matura - Kemija 2008marija kusturaNo ratings yet
- Organski Spojevi S KisikomDocument113 pagesOrganski Spojevi S KisikomMarin ProtulipacNo ratings yet
- Ponavljanje Gradiva-Alk, ZemnoalkDocument44 pagesPonavljanje Gradiva-Alk, ZemnoalkmandaNo ratings yet
- Zadatci - Kemija Opća I AnorganskaDocument5 pagesZadatci - Kemija Opća I Anorganskamarko_hržaNo ratings yet
- Skripta - Uvod U Kem Analizu - II Dio PI-BIDocument55 pagesSkripta - Uvod U Kem Analizu - II Dio PI-BIilija_culap14No ratings yet
- Ispitni-Rok-19 06 2017Document1 pageIspitni-Rok-19 06 2017Marin MilicevicNo ratings yet