Professional Documents
Culture Documents
CH5例習題
CH5例習題
Uploaded by
蔡承德Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
CH5例習題
CH5例習題
Uploaded by
蔡承德Copyright:
Available Formats
5.
1 生物催化劑──酵素 169
飲食中的維生素是許多酵素輔酶的前驅物,例如維生素 B1(thiamine)是硫胺素焦
磷酸(TPP)的前驅物,硫胺素焦磷酸是丙酮酸去氫酶複合體(pyruvate dehydrogenase
complex)的輔酶之一。因為高等生物無法自行合成維生素,所以飲食中所攝取的維生素,
對生物體的生長及發育相當重要,表 5.3 列出常見的輔酶及其相關維生素的種類,與缺乏
時所衍生的病症。相較於對衍生自水溶性維生素相關輔酶的瞭解,脂溶性維生素在輔酶功
能上所扮演的角色,目前並不清楚。
表 5.3 維生素衍生的相關輔酶種類及其反應類型與維生素缺乏症狀
維生素 相關輔酶 輔酶反應類型 缺乏症狀
硫胺素(維生素 B1) 硫胺素焦磷酸(TPP) 去羧反應 腳氣病
[thiamine (vitamin B1)]
核黃素(維生素 B2) FAD、FMN 氧化還原反應 生長遲緩
[riboflavin (vitamin B2)]
菸鹼酸(維生素 B3) NAD+、NADP+ 氧化還原反應 癩皮症
[niacin (vitamin B3)]
泛酸(維生素 B5) 輔酶 A 醯基的活化與 皮膚炎
[pantothenic acid (vitamin B5)] 轉移
吡哆醇、吡哆醛、吡哆酸(維生素 B6) 吡哆醛磷酸(PLP) 胺基的轉移 皮膚炎、痙攣
[pyridoxine (vitamin B6)]
生物素(維生素 B7) 生物素 CO2 的攜帶 皮膚炎
[biotin (vitamin B7)]
葉酸(維生素 B9) 四氫葉酸 碳基的轉移 巨母細胞性貧血
[folic acid (vitamin B9)]
鈷胺素(維生素 B12) 5′-去氧嘌呤鈷胺素 甲基化反應 巨幼細胞性貧血
[cobalamine (vitamin B12)]
L-抗壞血酸(維生素 C) L-抗壞血酸 羥化反應 壞血病
[L-absorbic acid (vitamin C)]
例題 5.1
關於酶之活性部位與受質的作用,在 1890 年,Emil Fischer 提出鎖和鑰匙模式,而於
1958 年,Daiel Koshland 提出誘導-嵌合模式,試分別說明之?
答: 1. 鎖和鑰匙模式為解釋酶與受質作用的方式,酶的活性部位類似鎖,而受質就類似
鑰匙,特定的鑰匙只能開啟特定的鎖,故此模式說明了酶與受質的專一性,而把
酶的活性部位比喻成一個剛性且沒有彈性的結構。誘導- 嵌合模式為解釋酶活性
部位與受質結合會產生連續變化,反應前酶的活性部位並不會與受質非常密合,
受質與酶結合後會造成酶的構形發生改變,形成一個可以與受質的大小、形狀及
極性完全相密合的構形,使得受質與酶的作用更好。
z-ic23-05.indd 169 2017/2/8 下午 01:27:51
170 第 5 章 酵素
例題 5.2
試簡單解釋下列名詞:輔因子、輔酶、輔基、全酶及去輔基酶。
答: 1. 有些酶除了蛋白質主體外,還需要加入其他成分才具有完整活性,這些額外
成分稱為輔因子,輔因子可以是有機分子、有機金屬分子(又稱輔酶)或金屬離
子(Zn2+、Mg2+ 或 Cu2+ 等)。
2. 輔酶是指可協助酶活性的有機化合物或是有機金屬化合物。在反應過程中,輔酶
可以緊密地或是寬鬆地與酶結合。
3. 輔基是輔酶中可以利用共價鍵或是非共價鍵與酶緊密結合且必要的部分。
4. 蛋白質主體與輔因子結合形成具有完整的生物功能的酵素,稱為全酶。
5. 未接上輔因子不具完整功能的酵素稱為去輔基酶。
5.2 酵素反應熱力學
5.2.1 標準自由能變化
反應熱力學與酵素催化反應速率有密切的關係,當化學反應發生時,反應物與生成物
的自由能差值,稱為標準自由能變化(standard free energy-change,ΔG0)(圖 5.5),標
準自由能變化可以作為評估該反應是否可以自發性產生的參數。標準自由能變化 > 0,表
示此反應不會自然發生;反之,若反應的標準自由能變化 < 0,表示此反應會自然發生;
若標準自由能變化等於 0,則表示反應達到平衡(請見 10.2 節)。
但是標準自由能變化小於 0,只是顯示此反應是在熱力學上有利的,但並不表示反應
會即時快速發生。例如常溫常壓下,過氧化氫會自然分解成氧及水,但是在沒有催化劑參
過渡狀態 過渡狀態
(transition state) (transition state)
自由能
自由能
反應物 生成物
反應物
自由能變化 < 0 生成物 自由能變化 > 0
反應方向 反應方向
(a) (b)
圖 5.5 反應的標準自由能變化。(a)放能反應,標準自由能變化(ΔG0)小於 0;(b)吸能反
應,標準自由能變化(ΔG0)大於 0。
z-ic23-05.indd 170 2017/2/8 下午 01:27:51
172 第 5 章 酵素
圖 5.8 增加反應溫度對反應熱力學的影 加熱
能量
響。加熱可以提升反應物的起始位
能,因此可以增加反應的速率。 室溫
反應物 生成物
反應方向
都有增加反應速率的效應,但兩者不同的是:酵素是蛋白質分子,所以在低於酵素最適反
應溫度的情況下,反應速率會隨著溫度的增加而上升。但是若加熱溫度超過最適反應溫度
後,因為高溫會造成蛋白質的變性,所以反應速率反而會急速下降(圖 5.13),此特徵是
酵素催化與一般化學反應不同的地方。
例題 5.3
為何升高溫度可以增加 H2O2 分解為 H2O 及 O2 之反應速率?
答: 升高溫度可以增加 H2O2 的平均動能,以增加分子間的碰撞頻率,使得可越過能量
屏障的 H2O2 分子數目增加,所以加熱可使 H2O2 分解的反應速率增加。
例題 5.4
哪一個反應的熱力學參數,可以應用於評估化學反應是否可以自然發生?
答: 當化學反應發生時,反應物與生成物的自由能差值,稱為標準自由能變化(ΔG0),
標準自由能變化可以作為評估該反應是否可以自發性發生的參數。標準自由能變化
> 0,表示此反應不會自然發生;反之,若反應的標準自由能變化 < 0,表示此反應
會自然發生;若標準自由能變化等於 0,則表示反應達到平衡。
5.3 酵素反應動力學
5.3.1 米曼方程式
早期酵素催化反應的研究發現,在固定酵素濃度下增加反應受質的濃度,酵素的催化
速率會明顯增加。但是隨著受質濃度的增加,酵素的催化速率增加的比例會逐漸下降,最
後即使再增加受質的濃度,酵素的催化速率也不再變化,此時酵素的催化反應速率稱為最
大反應速率(maximum velocity,Vmax)。以受質濃度與酵素催化活性作圖,可以發現圖
形屬於雙曲線(圖 5.9)。
z-ic23-05.indd 172 2017/2/8 下午 01:27:51
176 第 5 章 酵素
例題 5.5
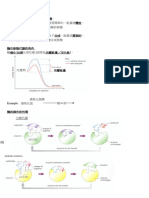
請畫出在定量酵素下,增加受質濃度對反應速率變化的圖形,並說明何謂最大反應速率。
答: 1.
Vmax
(initial velocity)
反應初速率
(v0)
受質濃度 [S]
(substrate concentration)
2. 在受質濃度相對低時,增加受質濃度會使反應速率有明顯的增加,但若在受質濃
度較高的條件下,由於酵素的數量是固定的,即使增加受質濃度,反應速率幾乎
不再變化或增加,此結果為一雙曲線,此時酵素的催化反應速率已達到最大限
度,以 Vmax 表示。
例題 5.6
在米曼方程式中,K m 的數值大小所代表的生理意義為何?
1
答: Km 是指酵素反應的初速率達到最大反應速率一半( 2 Vmax)時的受質濃度,Km 可以
作為酵素對受質親和力的指標,若受質的 Km 越小,表示酵素對此受質的親和力越
高。
5.4 酵素活性的抑制與調節
細胞內的酵素活性並非固定不變,有許多因素會影響酵素的活性,本節將介紹各種酵
素活性的抑制與調節機制。
5.4.1 抑制劑
抑制劑是指可以透過與酵素的作用,降低或是干擾酵素反應速率的物質。有許多藥
物或毒素的作用,就是透過對酵素活性的抑制。依照抑制劑的作用是否為可逆反應,可以
區分為可逆性抑制劑(reversible inhibitor)及不可逆性抑制劑(irreversible inhibitor)。可
逆性抑制劑與酵素的作用力較弱,當抑制劑被移除後,酵素可以回復原來的活性。不可逆
z-ic23-05.indd 176 2017/2/8 下午 01:27:52
186 第 5 章 酵素
例題 5.7
藉由研究酵素(酶)之抑制劑,可以獲得哪些資訊及應用,試舉兩例說明之。
答: 1. 研究酵素的天然抑制劑,可以瞭解細胞內的代謝過程與酵素調節作用之相關性。
2. 許多藥物的藥效及毒物的毒性,就是透過抑制劑來抑制酵素的活性而達成。研究
抑制劑的作用,可以瞭解酵素的反應機制及酵素反應時各種胺基酸所扮演之角
色。
例題 5.8
依照抑制劑與酶作用之可逆性及競爭之形式,將酶的抑制劑分類,請簡述其特性。
答: 1. 不可逆性抑制劑:是指會與酶形成共價鍵或很強的非共價鍵之抑制劑,此類抑制
劑結合於酶與其受質連結或作用的胺基酸之官能基,造成酶永久地失去活性。
2. 可逆性抑制劑:是指與酶作用後仍可脫離的抑制劑,當它們與酶結合時才會造成
酶的失活。
(1) 競爭性抑制劑:抑制劑的結構與酶作用的受質之結構類似,且能結合到酶的
活性部位上,因此競爭性抑制劑會與受質競爭酶的同一個活性部位,當抑制
劑與酶結合後,受質便無法再結合上去。
(2) 非競爭性抑制劑:抑制劑和受質可以同時結合到酶上,且兩者會結合在酶的
不同位置,抑制劑的存在並不會影響受質與酶的結合,但是會干擾酶的催化
能力。
(3) 不競爭性抑制劑:是非競爭性抑制劑的一種特例,此抑制劑會讓受質先結合
到酶的活性部位上,然後本身再結合作用於活性部位之外的位置,即此抑制
劑只與 ES 複合體作用。
例題 5.9
在胰臟和胃中所合成的蛋白酶是沒有活性的形式,如何能使其產生活性?為何要有這種
機制?
答: 1. 有些酶剛被合成時並不具有生物活性,這個不具生物活性的酶前驅物稱為酶原,
其必須經過蛋白酶專一性裂解,產生一個或數個胜肽後,才具有活性。在生物體
內有一些重要的酶就是透過蛋白酶的裂解來調節酶的活性,酶原切割的活化作用
是不可逆的反應,裂解會使酶的三級結構發生變化,並使酶原內部的活性部位顯
露出來。
2. 若這些蛋白酶一合成即有活性,則會馬上分解胰臟和胃中其他的酵素及結構蛋
白,並對器官造成傷害。
z-ic23-05.indd 186 2017/2/8 下午 01:27:54
5.5 同功酶 187
例題 5.10
試舉出二種利用化學修飾來調節酶活性之方式。
答: 1. 對酶分子中的絲胺酸、酥胺酸或酪胺酸側鏈上的羥基(- OH)進行磷酸化作用。
2. 半胱胺酸上雙硫鍵的還原作用。
5.5 同功酶
同功酶(isoenzyme)是指具有相同催化活性,但是其成分與構造不同的一群酵素,
這群酵素通常具有不同的反應動力學參數(如 Km 或 Vmax),可見每一種同功酶結合受質
的親和力可能不同,催化能力也有所差異。所以在特定的生理需求下,細胞可以藉由不同
組織同功酶的活性變化,來調節代謝反應。由於同功酶特異性的組織分布,從血清中特定
同功酶成分的異常增加,能夠作為偵測器官病變的訊號。
廣泛存在人體組織的乳酸去氫酶(lactate
dahydrogenase;LDH)是目前被研究最清楚, 表 5.4 人體乳酸去氫酶同功酶的次單元
組成及主要分布組織
而且被應用於臨床診斷用途的同功酶之一,細
類型 次單元組成 分布組織
胞內的乳酸去氫酶主要功能是催化丙酮酸與乳
LDH-1 H4(HHHH) 心肌與紅血球
酸之間相互轉換的反應。在構造上,乳酸去氫
LDH-2 H3M(HHHM) 心肌與紅血球
酶是由四個次單元所組成的四聚體蛋白質,組
LDH-3 H2M2(HHMM) 肺臟
成乳酸去氫酶的次單元有兩種類型:H 型與 M
LDH-4 HM3(HMMM) 腎臟與肝臟
型,它們是由不同基因所編譯的具有兩種相似
LDH-5 M4(MMMM) 骨骼肌與肝臟
胺基酸序列的多胜肽鏈,由 H 及 M 次單元所組
成的四聚體,共有五種不同的組合方式:H4、
H3M、H2M2、HM3、M4(表 5.4)。
人體內心肌與紅血球細胞中主要的乳
酸去氫酶為 LDH-1 與 LDH-2,肺、脾和淋
巴結等組織中以 LDH-3 為主,骨骼肌與肝
細胞中則以 LDH-5 為最多,不同組織中乳
酸去氫酶同功酶的成分與濃度存在明顯的
特殊性。通常成人正常血清中濃度最高的
是 LDH-2,發生心肌梗塞時,血清中 LDH-
1 的濃度會上升,使得 LDH-1/LDH-2 的比
值會變大,甚至會大於 1。因此,透過電泳
法分析血清中乳酸去氫酶同功酶的成分與比
例(圖 5.25),據以瞭解組織病變發生的位
置,可以作為臨床診斷的用途。 圖 5.25 不同乳酸去氫酶同功酶以電泳分離
的示意圖。M:標準樣品,A、B、
C:未知物。
z-ic23-05.indd 187 2017/2/8 下午 01:27:54
188 第 5 章 酵素
例題 5.11
什麼是同功酶?試舉一應用於臨床診斷用途的例子,並敘述其原理。
答: 1. 同功酶是指具有相同催化活性,但是其成分與構造不同的一群酵素,這群酵素通
常具有不同的反應動力學參數(如 Km 或 Vmax)與特異性的組織分布。
2. 乳酸去氫酶是由 H 型或 M 型兩種多胜肽鏈次單元所組成的四聚體蛋白質,包括
H4、H3M、H2M2、HM3、M4 等五種組合。人體內心肌細胞主要的乳酸去氫酶成
分為 H4,骨骼肌細胞則以 M4 為最多,不同組織中乳酸去氫酶同功酶的成分與濃
度存在明顯的差異。通常成人正常血清中濃度最高的是 H3M,發生心肌梗塞時,
血清中 H4 的濃度會上升,使得 H4 / H3M 的比值會變大,透過電泳法分析血清中
乳酸去氫酶同功酶的成分濃度與比例,據以瞭解組織病變發生的位置,可以作為
臨床診斷的用途。
5.6 酵素在臨床上的應用
一般正常的生理狀況下,細胞會不斷地製造及死亡,所以當細胞死亡後,細胞內的酵
素會釋放至血液中。當組織受到傷害造成細胞大量壞死,血液中酵素的含量會明顯上升,
所以分析血液中特定酵素的含量變化,可以作為臨床診斷或疾病監測的指標。
5.6.1 肝指數:AST 與 ALT
在醫院或健檢時常進行肝臟生化檢查,報告中所謂的肝指數即是分析血液中轉胺
酶的變化,臨床中常被分析的轉胺酶類型有兩種:天門冬胺酸轉胺酶(AST;aspartate
transaminase)又被稱為麩胺醯草醯乙酸轉胺基酶(GOT;glutamyl oxaloacetate transami-
nase), 丙 胺 酸 轉 胺 酶(ALT;alanine transaminase) 又 被 稱 為 麩 胺 酸 丙 酮 酸 轉 胺 基 酶
(GPT;glutamyl pyruvate transaminase)。
丙胺酸轉胺酶(ALT)主要存在於肝細胞中,天門冬胺酸轉胺酶(AST)則存在於肝
臟、腦部、心肌、腎臟等臟器或細胞中。當肝臟受到酒精、病毒感染或藥物的作用被破壞
時,壞死的肝細胞會將這兩種酵素釋放至血液中,因此血液中這兩種轉胺酶的數值會顯著
上升,而血液中轉胺酶的正常數值一般小於 40 U/L。
5.6.2 肌酸激酶及乳酸去氫酶
肌酸激酶(creatine kinase;CK)同功酶存在於骨骼肌細胞、心肌細胞及腦細胞,透
過比對血液中肌酸激酶異常,可以協助診斷是何種組織發生病變。當發生心肌梗塞或心肌
炎等心臟病變時,血液中心肌來源的肌酸激酶(CK-MM,M 為兩種次單元之一)會顯著
上升。乳酸去氫酶同功酶也常被應用於臨床診斷,透過分析血液中異常的乳酸去氫酶同功
酶的類型,可以作為診斷心臟、肌肉或腎臟病變的指標。
z-ic23-05.indd 188 2017/2/8 下午 01:27:54
本章總結 189
5.6.3 急性胰臟炎指標:澱粉酶及脂肪酶
澱粉酶及脂肪酶是胰臟所分泌的消化酵素,其中澱粉酶參與飲食中碳水化合物的水
解,脂肪酶參與脂質的分解。當胰臟受損或發炎時,消化食物的外分泌系統受到影響,造
成血液中澱粉酶及脂肪酶的濃度上升。
5.6.4 血糖的測定:葡萄糖氧化酶
血糖測定是糖尿病診斷與治療追蹤的重要檢驗項目,在眾多血糖定量方法中,葡萄糖
氧化酶檢驗法因為靈敏且對葡萄糖專一性高,不易受檢體中其他醣類的干擾,因此常被採
用。
例題 5.12
為何釋放至血液的細胞內酵素含量,可以應用於臨床疾病的診斷?
答: 一般正常的代謝反應,細胞會不斷地被製造及破壞,所以當細胞被破壞後,細胞內
的酵素會釋放至血液中。當組織受到傷害造成細胞大量壞死,血液中酵素的含量會
明顯上升,所以分析血液中特定酵素的含量變化,可作為臨床診斷或疾病監測的指
標。
本章總結
1. 生物體內的代謝反應都需要酵素分子的 3. 反應熱力學與酵素催化反應速率有密切
參與,目前有兩種解釋酵素催化專一性 的關係。反應物與生成物的自由能差稱
的模式被提出:鎖和鑰匙模式及誘導 - 為標準自由能變化,其可以作為評估該
嵌合模式。鎖和鑰匙模式強調的是:受 反應是否可以自發性產生的參數,若反
質與酵素兩者在幾何結構上具有高度的 應的標準自由能變化 < 0,表示此反應
互補性;誘導-嵌合模式則認為受質與 會自然發生。酵素的催化反應並不會改
酵素進行結合時,會誘導酵素產生結構 變標準自由能差,但是可以降低反應的
的變化,使兩者產生互補性的嵌合。目 活化能,因而促進催化反應的進行。
前研究結果發現誘導-嵌合模式比較接 4. 米曼方程式被應用於酵素催化動力學
近實驗的觀察。 研究,此方程式中的 Michaelis 常數:
2. 國 際 生 物 化 學 及 分 子 生 物 學 學 會 1
Km,是指在 2 Vmax 時的受質濃度;Km
(IUBMB)發展了一套依酵素的催化特 可以作為酵素對受質親和力的指標,Km
性作為命名準則的國際名稱,此分類法 越小表示酵素對此受質的親和力越高。
每個酵素有四個碼來代表,其中第一個 萊恩威弗-伯克氏圖是將米曼方程式進
號碼代表酵素的催化類型,依此系統酵 行雙倒數運算,萊恩威弗-伯克氏圖的
素的催化分為六大類型。 直線會在 1/v0 及 1/[S] 產生交會,此直
z-ic23-05.indd 189 2017/2/8 下午 01:27:54
190 第 5 章 酵素
線 在 1/v0 軸 的 截 距 為 1/Vmax, 在 1/[S] 不是典型的米曼模式而是 S 型,具有這
軸 上 的 截 距 為 –1/Km, 此 線 的 斜 率 為 種特徵的酵素稱為異位酵素,目前有兩
Km/Vmax,由於直線的截距與斜率只有 種解釋異位酵素協同作用的模式:協同
一個值,因此可以透過數學作圖的方 模式與序列模式。
式,求得精準的 Vmax 及 Km。 8. 有些酵素可以透過共價修飾作用,進行
5. 細胞內的酵素活性並非固定不變的,有 活性的調節。當酵素結構中的胺基酸被
許多因素會影響酵素的活性,例如抑制 共價接上一些官能基後,酵素的活性會
劑。依照抑制劑的作用是否可逆,可以 發生變化,例如與血糖恆定相關的肝醣
區分為可逆性抑制劑及不可逆性抑制 磷酸化酶及肝醣合成酶活性調控是典型
劑。 透過共價鍵結調節的例子。許多蛋白質
6. 抑制劑依照其與酵素的結合位置是否為 是透過裂解反應進行功能的調節,例如
活性部位,以及抑制劑結合的時機,可 凝血反應、補體活化反應、胰島素活化
以區分為競爭性抑制作用、非競爭性抑 及蛋白酶活化等反應,均與蛋白質裂解
制作用及不競爭性抑制作用,這些抑制 反應有關。
作用可以用萊恩威弗-伯克氏圖進行比 9. 同功酶是指具有相同催化活性,但是胺
較。 基酸序列不同的一群酵素。這些酵素通
7. 回饋抑制又稱為終產物回饋抑制,此調 常具有不同的反應動力學參數(如 Km
節機制可以在反應的產物之濃度過高 或 Vmax),或特異的組織分布。血液中
時,抑制合成此產物的酵素或是關鍵酵 同功酶的變化,已被應用於臨床診斷,
素的活性。有些酵素的反應速率曲線並 例如乳酸去氫酶及肌酸激酶。
本章習題
5.1 生物催化劑——酵素 (C) 生物素 (D) NADH
1. 下列有關酶的敘述,何者正確? 4. 下列有關酶與受質結合的敘述,何者
(A) 酶只和特定型態的受質作用 錯誤?
(B) 所有的酶都是由蛋白質所組成 (A) 酶的活性部位只占酶的小部分空間
(C) 酶在催化反應中會被消耗 (B) 鎖和鑰匙模式中酶的結構為剛性構
(D) 酶不能重複跟其他相同的受質分子 形
作用 (C) 酶的活性部位利用非共價性交互作
2. 下列何者是體內合成 NAD+ 的前驅物? 用與受質結合
(A) 核黃素 (B) 泛酸 (D) 誘導-嵌合模式推論受質的構形會改
(C) 菸鹼酸 (D) 硫胺酸 變至可以結合酶活性部位
3. 下列哪一個輔酶常伴隨乙醯輔酶 A 羧化 5. 比較說明鎖和鑰匙以及誘導-嵌合這兩
酶的催化作用? 種酵素與受質的結合模式。
(A) NADPH (B) FAD 6. 在急診室中乙醇常用來治療誤食甲醇的
患者;甲醇在體內會經由去氫酶的催化
z-ic23-05.indd 190 2017/2/10 上午 11:30:55
本章習題 191
作用,轉為有毒性的甲醛,而對人體造 (A) LDH-1 (B) LDH-2
成傷害。請從酵素抑制作用的觀點來解 (C) LDH-3 (D) LDH-4
釋乙醇可用來治療的原因。
5.4 酵素活性的抑制與調節
5.2 酵素反應熱力學 12. 在檸檬酸循環的反應過程中,琥珀酸去
7. 下列有關酵素的敘述,何者錯誤? 氫酶可以催化琥珀酸進行氧化反應;但
(A) 酵素可以改變反應的平衡常數 是當有丙二酸存在時,反應則會受到抑
(B) 酵素可以加速反應的進行 制,主要原因是丙二酸的分子結構與受
(C) 酵素不能改變反應的標準自由能變 質—琥珀酸類似。(1)請說明在酵
化 素抑制現象中,上述的丙二酸是屬於哪
(D) 酵素會降低反應過程中的活化能 一類型的抑制劑?(2)目前製藥公司
8. 降低反應中的何種數值,可以增快反應 在研發新藥品時也是將藥品分子設計成
速率? 受質類似物,也請說明其主要的觀念為
(A) 反應熱 何?
(B) 平衡常數 13. 下列有關抑制劑的敘述,何者錯誤?
(C) 標準自由能變化 (A) 競爭性抑制劑會和受質同時競爭同
(D) 活化能 一活性部位
(B) 不可逆抑制劑與酶以共價鍵結合
5.3 酵素反應動力學
(C) 丙二酸可抑制琥珀酸去氫酶的活性
9. 下列哪一個圖形可以代表:在定量酵素
是因丙二酸為競爭性抑制劑
而增加受質濃度下的反應速率變化情
(D) 用乙醇來治療甲醇中毒是利用不競
形?
爭性抑制作用的原理
14. 在酵素抑制作用過程中增加受質濃度,
(A) (B) (C) (D)
何種抑制作用不會受到影響?
V V V (A) 競爭性 (B)
V 非競爭性
(C) 不競爭性 (D) 不可逆性
[S] [S] 15. 下列何者會促進肝醣的合成作用?(複
[S] [S]
選)
(B) (C) (D)
(A) 去磷酸化的肝醣合成酶
V V V
(B) 磷酸化的肝醣合成酶
(C) 去磷酸化的肝醣磷酸化酶
[S] [S] [S] (D) 升糖素
(E) 胰島素
10. 進行酵素反應動力學分析實驗時,為何 16. 下列有關異位酵素的序列模式的敘述,
利用萊恩威弗-伯克氏圖,可以得到較 何者正確?(複選)
精準的 Vmax 及 Km ? (A) 異位酵素二聚體酵素,能以 RT 形
11. 人體內肺、脾和淋巴結等組織中主要的 式存在
乳酸去氫酶為何種形式? (B) 異位酵素二聚體酵素,能以 RR 形
z-ic23-05.indd 191 2017/2/8 下午 01:27:55
192 第 5 章 酵素
式存在 5.5 同功酶
(C) RR 形式的二聚體酵素親和力高 20. 下列有關同功酶的敘述,何者錯誤?
(D) TT 形式的二聚體酵素親和力高 (A) 催化相似的生化反應
(E) TT 形式轉變成 RR 形式,是一步驟 (B) 具有相同的胺基酸組成與順序
完成的 (C) 在人體組織及器官的分布比例不同
17. 下列有關異位酵素的協同模式的敘述, (D) 乳酸去氫酶是由 H 和 M 次單元所
何者正確?(複選) 組成的四聚體,共有五種同功酶
(A) 異位酵素二聚體酵素,能以 RT 形 21. 何謂同功酶?請解釋同功酶在臨床上為
式存在 何可用來作為疾病診斷的依據。
(B) 異位酵素二聚體酵素,能以 RR 形 22. 下列何種數值可以作為酵素對受質親和
式存在 力的指標,且數值越小,表示酵素對此
(C) RR 形式的二聚體酵素親和力高 受質的親和力越高。
(D) TT 形式的二聚體酵素親和力高 (A) 最大反應速率 (B) 米凱利斯常數
(E) TT 形式轉變成 RR 形式,是一步完 (C) 受質濃度 (D) 反應的初始速率
成的 23. 在急診室一胸部疼痛病患的血液報告,
18. 下列有關胰凝乳蛋白酶原進行裂解反應 顯示其乳酸去氫酶中的 LDH-1 含量偏
的敘述,何者錯誤? 高。請以生化的觀點解釋上述狀況。
(A) 將不具活性的酶原變成具有活性的
5.6 酵素在臨床上的應用
酵素
(B) 酶原的結構會發生變化 24. 市售保健食品宣稱有保肝功能時,常宣
(C) 埋於酶原內部的活性部位會顯露出 稱具降低 GOT 及 GPT 的效果,為何降
來 低血中 GOT 及 GPT 數值與護肝有關?
(D) 裂解是可逆的反應 25. 當肌肉因外力或是過度運動造成嚴重
19. 請分別敘述在酶的抑制作用中,競爭性 損傷後,有些人會產生「橫紋肌溶解
抑制作用、非競爭性抑制作用及不競爭 症」,在臨床上是利用血液中哪個酵素
性抑制作用的差異點。 的含量,作為肌肉組織是否受損的指
標?
z-ic23-05.indd 192 2017/2/8 下午 01:27:55
You might also like
- DSE BioDocument359 pagesDSE BioliNo ratings yet
- HermanYeung DSE Bio CH 1 Temp NoteDocument57 pagesHermanYeung DSE Bio CH 1 Temp NoteliNo ratings yet
- 99 紅外線Document101 pages99 紅外線蔡承德No ratings yet
- 臨床血清免疫學 特論課 技術Document98 pages臨床血清免疫學 特論課 技術Brian C.C YangNo ratings yet
- 4. 中樞神經藥物1 - 興奮 - 安眠Document70 pages4. 中樞神經藥物1 - 興奮 - 安眠蔡承德No ratings yet
- 第三章 酶 2015-3Document59 pages第三章 酶 2015-3趙偉光No ratings yet
- 段考錦囊 高二下第二次段考 化學Document10 pages段考錦囊 高二下第二次段考 化學古湯姆No ratings yet
- 普通高中教科书·化学选择性必修1 化学反应原理Document139 pages普通高中教科书·化学选择性必修1 化学反应原理shuttletongsNo ratings yet
- 选择性必修1Document139 pages选择性必修1yedewei19951226No ratings yet
- 12 Extra - 酶與新陳代謝(筆記)Document7 pages12 Extra - 酶與新陳代謝(筆記)KelvinNo ratings yet
- 第4章Document3 pages第4章sheng caoNo ratings yet
- TE Unit 44 (C)Document41 pagesTE Unit 44 (C)Yau JonathanNo ratings yet
- 了解氧化态Document9 pages了解氧化态kyrvinwlfNo ratings yet
- 如何确定氧化态Document9 pages如何确定氧化态afmoiabesNo ratings yet
- 代謝 (Metabolism)Document55 pages代謝 (Metabolism)蕭曉梅No ratings yet
- ch04c BioDocument7 pagesch04c BioGENIUS GGECNo ratings yet
- Test 1A ch04 CDocument10 pagesTest 1A ch04 Cyuenching chungNo ratings yet
- 固定化酶Document19 pages固定化酶姚竣之go.thuNo ratings yet
- 高醫生物化學歷屆試題Document43 pages高醫生物化學歷屆試題張宏軒No ratings yet
- 段考錦囊 高二下第三次段考 化學Document10 pages段考錦囊 高二下第三次段考 化學古湯姆No ratings yet
- 期末重點整理Document8 pages期末重點整理s110065011No ratings yet
- 115普化 (II) 期末重點16 21Document69 pages115普化 (II) 期末重點16 21王浩宇No ratings yet
- 【考古】生化期中考IDocument4 pages【考古】生化期中考Izarkary1026No ratings yet
- 105 111年生化考古題Document56 pages105 111年生化考古題a70180No ratings yet
- Module - Lesson 5Document29 pagesModule - Lesson 5maria elaine melo colesioNo ratings yet
- 化學平衡Document28 pages化學平衡wildgoose1428No ratings yet
- 2023版高中同步新教材选择性必修1鲁科化学主书正文第1章Document41 pages2023版高中同步新教材选择性必修1鲁科化学主书正文第1章Kevin LinNo ratings yet
- 三肼基均三嗪制备的研究Document2 pages三肼基均三嗪制备的研究黄利好No ratings yet
- 1 3Document11 pages1 3艾薇艾薇No ratings yet
- 95 2 2Document8 pages95 2 2092傅宏仁No ratings yet
- 1-4 PointDocument9 pages1-4 Point王大明No ratings yet
- 生物化学名词解释集锦Document9 pages生物化学名词解释集锦ビNo ratings yet
- F3 Enzyme ws03Document2 pagesF3 Enzyme ws03Bleh Bleh blehNo ratings yet
- Chem 53 (2nd) Chi PDFDocument24 pagesChem 53 (2nd) Chi PDFsteven kuiNo ratings yet
- 高分子化学 - 第二章 自由基聚合(Free radical polymerization)Document42 pages高分子化学 - 第二章 自由基聚合(Free radical polymerization)Shawn ZhengNo ratings yet
- 吩噻嗪合成的工艺研究 PDFDocument4 pages吩噻嗪合成的工艺研究 PDFBloodRoNo ratings yet
- 08期Document4 pages08期Patrick StarNo ratings yet
- 8第八章发酵过程 PDFDocument294 pages8第八章发酵过程 PDFzhoujingyaoscribdNo ratings yet
- Chem 52 (2nd) Chi PDFDocument24 pagesChem 52 (2nd) Chi PDFsteven kuiNo ratings yet
- "酶"专题知识 (知识 练习 答案)Document9 pages"酶"专题知识 (知识 练习 答案)Foong YenyeeNo ratings yet
- 生物化學重要物質分析方法Document5 pages生物化學重要物質分析方法張宏軒No ratings yet
- 3Document82 pages3api-263846648No ratings yet
- 生化作業─梅玉瑩Document8 pages生化作業─梅玉瑩NG SIRNo ratings yet
- 第4章 其他习题Document3 pages第4章 其他习题sheng caoNo ratings yet
- 2023版高中同步新教材选择性必修1鲁科化学主书答案Document72 pages2023版高中同步新教材选择性必修1鲁科化学主书答案Kevin LinNo ratings yet
- 生物练习题Document10 pages生物练习题王占玺No ratings yet
- 第四章 可控缩合聚合Document67 pages第四章 可控缩合聚合jinzifeng2001No ratings yet
- AntibodyDocument14 pagesAntibody鄭宇揚No ratings yet
- 1 反應速率與平衡Document4 pages1 反應速率與平衡Shu Shujaat LinNo ratings yet
- 112100 55 生物化學與臨床生化學Document14 pages112100 55 生物化學與臨床生化學sunNo ratings yet
- 高分子化学第五章Document68 pages高分子化学第五章curioussssNo ratings yet
- CH4第一階段代謝Document19 pagesCH4第一階段代謝夏雪惹No ratings yet
- Chapter 1 WaterDocument34 pagesChapter 1 WaterbbojsmbswpswgnsperNo ratings yet
- 生物词汇Document237 pages生物词汇Dc JiangNo ratings yet
- 2018 2019学年北京市中央民大附中高一(上)月考生物试卷(10月份) 解析Document21 pages2018 2019学年北京市中央民大附中高一(上)月考生物试卷(10月份) 解析侯老板No ratings yet
- BiocatOrgan SynthDocument71 pagesBiocatOrgan SynthRahim KalathilNo ratings yet
- 酵母细胞甘油代谢与生理功能研究进展Document9 pages酵母细胞甘油代谢与生理功能研究进展naphtholNo ratings yet
- 03+04precipitation and Agglutination ReactionsDocument13 pages03+04precipitation and Agglutination Reactionsrosalam813No ratings yet
- Improved Synthesis Technology of 5-Nitrosalicylic AcidDocument2 pagesImproved Synthesis Technology of 5-Nitrosalicylic AcidSyeda SadiaNo ratings yet
- 專題鐵離子Document31 pages專題鐵離子s0900116361No ratings yet
- 06.分子振動計算與 IR - Raman光譜計算Document4 pages06.分子振動計算與 IR - Raman光譜計算蔡承德No ratings yet
- 細胞色素P450Document8 pages細胞色素P450蔡承德No ratings yet
- 03 分子結構的建立Document3 pages03 分子結構的建立蔡承德No ratings yet
- 物化筆記Document43 pages物化筆記蔡承德No ratings yet
- Inorganic Chemistry 第一次考試總整理Document1 pageInorganic Chemistry 第一次考試總整理蔡承德No ratings yet
- 儀分第一次考試重點Document4 pages儀分第一次考試重點蔡承德No ratings yet
- CH4 題庫與解答Document5 pagesCH4 題庫與解答蔡承德No ratings yet
- Group TheoryDocument51 pagesGroup Theory蔡承德No ratings yet
- 分析期中考Document55 pages分析期中考蔡承德No ratings yet
- 電化學chapter22Document1 page電化學chapter22蔡承德No ratings yet
- 精神用藥Document1 page精神用藥蔡承德No ratings yet
- 分子對稱Document51 pages分子對稱蔡承德No ratings yet
- 3-1 DPBMN之吸收及螢光光譜Document69 pages3-1 DPBMN之吸收及螢光光譜蔡承德No ratings yet
- 3. 藥效藥動Document52 pages3. 藥效藥動蔡承德No ratings yet
- Pta 8835 5718945 82798Document13 pagesPta 8835 5718945 82798蔡承德No ratings yet
- 投影片25 PDFDocument33 pages投影片25 PDF蔡承德No ratings yet
- JGJ102-2002 - Chinese VersionDocument94 pagesJGJ102-2002 - Chinese VersionmyduythanhNo ratings yet
- 桂林碳酸盐岩与岩溶发育的关系 翁金桃Document13 pages桂林碳酸盐岩与岩溶发育的关系 翁金桃王小波No ratings yet
- QM DY2(球磨机说明书)Document14 pagesQM DY2(球磨机说明书)wu.ruixue1120No ratings yet
- 第三章 第一节 卤代烃Document7 pages第三章 第一节 卤代烃daisuki baiheNo ratings yet
- 初中化学知识手册上(全国通用版)Document13 pages初中化学知识手册上(全国通用版)fan yangNo ratings yet