Professional Documents
Culture Documents
ĐỀ KT HK1. TTĐ10 - ĐỀ 101
Uploaded by
Bé SôngOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
ĐỀ KT HK1. TTĐ10 - ĐỀ 101
Uploaded by
Bé SôngCopyright:
Available Formats
ĐỀ ÔN KIỂM TRA CUỐI KÌ I 2023 - 2023
Môn thi: Hóa học 10
(Thời gian: 50 phút)
MÃ ĐỀ: 101
Cho nguyên tử khối các nguyên tố: H=1; C=12; O=16; Na=23; Mg=24; Al=27;S = 32; Cl
=35,5; K=39; Ca = 40; Fe=56; Cu=64; Zn=65; Ba=137;
I. PHẦN TRẮC NGHIỆM (7,0 điểm)
Câu 1: Đặc điểm của hạt neutron là
A. mang điện tích dương và có khối lượng. B. mang điện tích âm và có khối lượng.
C. không mang điện và có khối lượng. D. mang điện tích âm và không có khối
lượng.
Câu 2: Lớp M có số electron tối đa là
A. 32. B. 18. C. 8. D. 2.
Câu 3: Phân lớp nào sau đây không tồn tại?
A. 1s. B. 3p. C. 4d. D. 2f.
Câu 4: Số nguyên tố trong chu kì 3 là
A. 2. B. 8. C. 18. D. 32.
Câu 5: X thuộc nhóm VA. Công thức oxide cao nhất của X là
A. XO2. B. XO. C. XO3. D. X2O5.
Câu 6: Trong một chu kì, theo chiều tăng của điện tích hạt nhân biến đổi nào sau đây đúng?
A. Tính acid giảm. B. Bán kính nguyên tử tăng.
C. Tính phi kim giảm. D. Độ âm điện tăng.
Câu 7: Nguyên tử nguyên tố nhóm IA nào sau đây có bán kính lớm nhất?
A. Li (Z=3). B. Na (Z=11). C. K (Z=19). D. Cs (Z=55).
Câu 8: Cấu hình electron hóa trị của nguyên tử các nguyên tố nhóm IVA trong bảng tuần hoàn
là
A. np2. B. ns2. C. ns2np2. D. ns2np4.
Câu 9: Theo quy tắc octet, xu hướng chung của các nguyên tử nguyên tố nhóm IIA là nhường
A. 2 electron. B. 3 electron. C. 1 electron. D. 4 electron.
Câu 10: Sodium chloride là một hợp chất có thể tan trong nước lạnh và có nhiệt độ nóng chảy
cao. Liên kết trong phân tử sodium chloride là liên kết
A. cộng hóa trị không phân cực. B. liên kết ion.
C. hydrogen. D. cộng hóa trị phân cực.
Câu 11: Trong các hợp chất sau: CaO, Ba(NO 3)2, Na2O, KF, K2SO4, NH4Cl, số hợp chất không
chứa ion đa nguyên tử là
A. 2. B. 3. C. 4. D. 5.
Câu 12: Phân tử nào sau đây có liên kết ion?
A. NH3. B. H2S. C. HCl. D. NaBr.
TRANG 1 (mã đề: 101)
Câu 13: Liên kết cộng hóa trị là liên kết được hình thành giữa hai nguyên tử
A. bằng nhiều electron chung. B. bằng sự cho – nhận electron.
C. bằng một hay nhiều cặp electron chung. D. bằng một hay nhiều electron độc thân.
Câu 14: Phân tử nào sau đây có liên kết cộng hóa trị phân cực?
A. O2. B. H2S. C. C2H2. D. NH3.
Câu 15: Phát biểu nào sau đây về tính chất của hợp chất cộng hóa trị là sai?
A. Có nhiệt độ nóng chảy và nhiệt độ sôi thấp.
B. Tồn tại ở thể rắn, lỏng hoặc khí trong điều kiện thường.
C. Tất cả các hợp chất cộng hóa trị đều dẫn điện tốt.
D. Hợp chất cộng hóa trị phân cực tan tốt trong dung môi phân cực.
Câu 16: Cho sơ đồ liên kết giữa hai phân tử acid CH3COOH:
Trong sơ đồ trên, đường nét đứt đại diện cho
A. Liên kết ion.
B. Liên kết hydrogen.
D. Liên kết cộng hóa trị.
D. Liên kết cho - nhận
Câu 17: Nguyên tử Al có số lượng các loại hạt proton, electron và neutron lần lượt là:
A. 15, 13 và 13. B. 15, 15 và 13. C. 13, 13 và 15. D. 13, 15 và 13.
Câu 18: Nguyên tố có Z= 25 thuộc loại nguyên tố
A. f. B. s. C. p. D. d.
Câu 19: Nguyên tố ở chu kì 3, nhóm VA có cấu hình electron là
A. [Ne]3s23p1. B. [Ne]3s23p4. C. [Ne]3s23p3. D. [Ne]3s23p6.
Câu 20: Cho cấu hình electron nguyên tử các nguyên tố sau: X (1s 22s22p63s23p64s1), Y
(1s22s22p63s1), Z (1s22s22p63s2), T (1s22s2). Dãy các nguyên tố được sắp xếp theo chiều tăng
dần tính kim loại từ trái sang phải là:
A. T, Z, X, Y. B. X, Y, T, Z. C. T, Z, Y, X. D. T, Y, Z, X.
Câu 21: Cho các nguyên tố cùng chu kỳ: 11Na ,12Mg, 13Al và 14Si. Dãy các nguyên tố được sắp
xếp theo chiều tăng dần tính phi kim từ trái sang phải là:
A. Na, Si, Mg, Al. B. Na, Mg, Al, Si. C. Si, Al, Mg, Na. D. Si, Na, Al, Mg.
Câu 22: Phát biểu nào sau đây về Ca (Z=20) không đúng?
A. Có 2 electron hóa trị.
B. Là nguyên tố s.
C. Hóa trị cao nhất với oxygen là II.
D. Hydroxide cao nhất của calcium có tính axit.
Câu 23: Theo quy tắc octet nguyên tử nào sau đây nhường 1 electron để đạt cấu trúc ion bền?
A. X (Z = 8). B. Y (Z = 9). C. T (Z = 11). D. Q (Z = 12).
Câu 24: Cho các phát biểu sau về hợp chất ion:
(a) Liên kết được tạo thành do lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
TRANG 2 (mã đề: 101)
(b) Được tạo thành giữa kim loại điển hình và phi kim điển hình.
(c) Có nhiệt độ nóng chảy và nhiệt độ sôi cao.
(d) Thường tồn tại ở trạng thái khí ở điều kiện thường.
Số phát biểu đúng là
A. 2. B. 1. C. 3. D. 4.
Câu 25: Nguyên tử X có 20 electron, nguyên tử Y có 9 electron. Công thức hợp chất và loại liên
kết hình thành giữa hai nguyên tử này là
A. XY2, liên kết ion. B. X3Y2, liên kết cộng hóa trị.
C. X2Y, liên kết cộng hóa trị. D. XY, liên kết ion.
Câu 26: Phân tử Cl2 được hình thành thừ sự xen phủ nào?
A. .
B. .
C. .
D. .
Câu 27: Dãy nào sau đây gồm các phân tử đều phân cực?
A. HCl, N2, NaCl, H2O. B. HCl, NH3, NaCl, CO2.
C. HCl, NH3, NaCl, O2. D. HCl, NH3, NaCl, H2O.
Câu 28: Chất nào sau đây không thể tạo được liên kết hydrogen?
A. H2O. B. C2H4. C. CH3OH. D. NH3.
II. PHẦN TỰ LUẬN (3,0 điểm)
Câu 29: (1 điểm)
a. Trong bản tuần hoàn các nguyên tố hóa học, các nguyên tố được sắp xếp theo những
nguyên tắc nào?
b. Nguyên tố X là là một thành phần quan trọng của khẩu phần dinh dưỡng. Sự thiếu hụt rất
nhỏ của nó đã ảnh hưởng tới sự hình thành và phát triển của xương và răng. Nguyên tố X
thuộc chu kì 4, nhóm IIA trong bản tuần hòa. Viết cấu hình e của nguyên tố X.
Câu 30: (1 điểm)
a) Viết hai giai đoạn của sự hình thành NaCl từ các nguyên tử tương ứng (kèm theo cấu hình
electron).
b) Viết công thức electron và công thức Lewis của phân tử NH3.
TRANG 3 (mã đề: 101)
Câu 31: (0,5 điểm) Dựa vào kiến thức đã học về liên kết hóa học hãy giải thích vì sao ethanol
C2H5OH tan vô hạn trong nước, khí nitrogen tan ít trong nước.
Câu 32: (0,5 điểm) Hợp chất M2X có tổng số hạt cơ bản trong phân tử là 116, trong đó số hạt
mang điện nhiều hơn số hạt không mang điện là 36. Số khối của X lớn hơn M là 9. Tổng số
hạt trong X2- nhiều hơn trong M+ là 17. Tính số neutron của nguyên tử M và X.
TRANG 4 (mã đề: 101)
ĐÁP ÁN
I. PHẦN TRẮC NGHIỆM
1.C 2.B 3.D 4.B 5.D 6.D 7.D 8.C 9.A 10.B
11.B 12.D 13.C 14.D 15.C 16.B 17.C 18.D 19.C 20.C
21.B 22.D 23.C 24.C 25.A 26.C 27.D 28.C
II. PHẦN TỰ LUẬN
Câ Đáp án Điể
u m
a.
- Nguyên tắc 1: Các nguyên tố được xếp theo chiều tăng dần của điện tích hạt 0,25
nhân nguyên tử.
- Nguyên tắc 2: Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp 0,25
29
thành một hàng (chu kì).
- Nguyên tắc 3: Các nguyên tố có cùng số electron hóa trị trong nguyên tử (cấu 0,25
hình electron tương tự nhau) được sắp xếp thành một cột (nhóm).
b. Cấu hình electron: 1s22s22p63s23p64s2 0,25
a.
0,25
Na Na+ + 1e
1s 2s 2p63s1
2 2
1s 2s 2p6
2 2
Cl + 1e Cl- 0,25
1s 2s 2p63s23p5
2 2
1s22s22p63s23p6
30 b.
0,25
0,25
Theo tính chất của các chất có liên kết cộng hóa trị:
- H2O là dung môi phân cực.
- C2H5OH có liên kết hydrogen với H2O. 0,25
31
Nên C2H5OH tan vô hạn trong nước.
- N2 có liên kết cộng hóa trị không phân cực nên N2 là phân tử không phân cực,
không tạo liên kết hydrogen với nước → tan ít trong nước. 0,25
TRANG 5 (mã đề: 101)
0,5
32
TRANG 6 (mã đề: 101)
You might also like
- Đề số 02Document4 pagesĐề số 02thainguyenduy008No ratings yet
- HÓA - ÔN TẬP CUỐI KÌ I - 2022 - ĐỀ LUYỆNDocument18 pagesHÓA - ÔN TẬP CUỐI KÌ I - 2022 - ĐỀ LUYỆNAnh KhoaNo ratings yet
- ĐỀ HK 1 SỐ 4Document7 pagesĐỀ HK 1 SỐ 4Lê Quốc LiệtNo ratings yet
- BỘ ĐỀ ÔN CUỐI KÌ 1Document14 pagesBỘ ĐỀ ÔN CUỐI KÌ 1helloisme933No ratings yet
- 23 - 24. Đề luyện HÓA 10 - GHKI - THPT Trần Quốc Tuấn - Gia LaiDocument5 pages23 - 24. Đề luyện HÓA 10 - GHKI - THPT Trần Quốc Tuấn - Gia LaiBảo TrânNo ratings yet
- ĐỀ KIỂM TRA HÓA HỌC 10 CUỐI HỌC KÌ 1 WORDDocument3 pagesĐỀ KIỂM TRA HÓA HỌC 10 CUỐI HỌC KÌ 1 WORDĐạt Trần VănNo ratings yet
- 22-23.hoa 10-HKI-GDTX BINH TAN-TP - HCM-btlongsp@gmail - Com - Thanh Long BùiDocument3 pages22-23.hoa 10-HKI-GDTX BINH TAN-TP - HCM-btlongsp@gmail - Com - Thanh Long BùiLinh NguyễnNo ratings yet
- ĐỀ HK 1 SỐ 1Document9 pagesĐỀ HK 1 SỐ 1Lê Quốc LiệtNo ratings yet
- Cuoi Ki 10CHDocument3 pagesCuoi Ki 10CHPhú Khang CaoNo ratings yet
- Doan 2023 - de 301Document3 pagesDoan 2023 - de 301Trần Trung TínhNo ratings yet
- Đề số 03Document6 pagesĐề số 03thainguyenduy008No ratings yet
- ĐC ÔN TẬP HK1 HÓA 10 (22-23)Document3 pagesĐC ÔN TẬP HK1 HÓA 10 (22-23)1TC-22ACN lớpNo ratings yet
- đề thi thử số 3 (chưa đáp án)Document2 pagesđề thi thử số 3 (chưa đáp án)An NguyễnNo ratings yet
- 10 Đề Thi Học Kì 1 - Hóa 12Document41 pages10 Đề Thi Học Kì 1 - Hóa 12Thy DoNo ratings yet
- Đề 5 - BTVN 15.12Document8 pagesĐề 5 - BTVN 15.12Ki KiNo ratings yet
- UntitledDocument4 pagesUntitledQuỳnh AnhNo ratings yet
- De inDocument3 pagesDe inDanh NguyễnNo ratings yet
- hoá đề2Document5 pageshoá đề2Hương BùiNo ratings yet
- CHƯƠNG 3 LIÊN KẾT HÓA HỌCDocument8 pagesCHƯƠNG 3 LIÊN KẾT HÓA HỌCLillian TranNo ratings yet
- ĐỀ ÔN TẬP HÓA 10 L1 10A1Document4 pagesĐỀ ÔN TẬP HÓA 10 L1 10A1Tuấn TrầnNo ratings yet
- MINH HỌA CUỐI KÌ 1 LỚP 10Document3 pagesMINH HỌA CUỐI KÌ 1 LỚP 10Sơn TrầnNo ratings yet
- Chương 3.2.liên Kết Hóa Học PDFDocument4 pagesChương 3.2.liên Kết Hóa Học PDFOffical PJayNo ratings yet
- Ma de 105Document3 pagesMa de 105doducanh30052007No ratings yet
- đề hoá 5Document3 pagesđề hoá 5Hương BùiNo ratings yet
- 04 Dekiemtra204Document4 pages04 Dekiemtra204nganlethikhanh0No ratings yet
- HSG 10 CỤM LỤC NAM BẮC GIANG 2023 MĐ 101Document4 pagesHSG 10 CỤM LỤC NAM BẮC GIANG 2023 MĐ 101tranminhquynh62No ratings yet
- Đề Cương Ôn Tập Học Kì 1 - Môn Hóa Học - Lớp 10Document9 pagesĐề Cương Ôn Tập Học Kì 1 - Môn Hóa Học - Lớp 10Oxybx Oxnbxnl100% (1)
- 10 Đề Kiểm Tra 1 Tiết Hóa 10 Chương 2 Bảng Tuần Hoàn Có Đáp ÁnDocument21 pages10 Đề Kiểm Tra 1 Tiết Hóa 10 Chương 2 Bảng Tuần Hoàn Có Đáp ÁnLan Anh HoàngNo ratings yet
- HSG 10 CỤM LỤC NAM BẮC GIANG - 2023 (MĐ 101)Document8 pagesHSG 10 CỤM LỤC NAM BẮC GIANG - 2023 (MĐ 101)Kiên Phạm HoàngNo ratings yet
- Đề Ôn Cuối Kì 1 Hoa -Khối 10Document13 pagesĐề Ôn Cuối Kì 1 Hoa -Khối 10Lillian TranNo ratings yet
- 23 - 24. Đề Hóa 10 - HKI - trường THPT Buôn Hồ - Dak LakDocument4 pages23 - 24. Đề Hóa 10 - HKI - trường THPT Buôn Hồ - Dak LakBảo TrânNo ratings yet
- Bo de On Thi HK1 Hoa 10 KNTTDocument4 pagesBo de On Thi HK1 Hoa 10 KNTTtathilinh0608No ratings yet
- 10. ĐỀ CƯƠNG ÔN TẬP HỌC KÌ IDocument5 pages10. ĐỀ CƯƠNG ÔN TẬP HỌC KÌ Inhat hoangNo ratings yet
- De Thi Hoc Ki 1 Hoa Hoc 10 KNTT de 3Document28 pagesDe Thi Hoc Ki 1 Hoa Hoc 10 KNTT de 3Tuấn TrầnNo ratings yet
- (TỜ HKI) BỘ ĐỀ KIỂM TRA HỌC KỲ 1, HOÁ 10-ĐỀ02Document3 pages(TỜ HKI) BỘ ĐỀ KIỂM TRA HỌC KỲ 1, HOÁ 10-ĐỀ02ltghuychuyenhlksk30No ratings yet
- cuối kìDocument17 pagescuối kìNguyễn Thị Mỹ HạnhNo ratings yet
- Azota Ôn KT Gi A Kì 1Document5 pagesAzota Ôn KT Gi A Kì 1Nguyen MinhNo ratings yet
- De Minh Hoa 2025 Mon Hoa 29 12Document6 pagesDe Minh Hoa 2025 Mon Hoa 29 12Phạm Bá KhánhNo ratings yet
- 22-23. Hóa 10-cuối HKI-THPT Lương Sơn - Hòa Bình-hungbui.hb@gmail.com - Hưng BùiDocument12 pages22-23. Hóa 10-cuối HKI-THPT Lương Sơn - Hòa Bình-hungbui.hb@gmail.com - Hưng BùiLinh NguyễnNo ratings yet
- De Thi Hoc Ki 1 Hoa 10 Chan Troi Sang Tao de So 1 1700730592Document9 pagesDe Thi Hoc Ki 1 Hoa 10 Chan Troi Sang Tao de So 1 1700730592lelinh2037No ratings yet
- In-Thi Hoc Ki 1 Hoa 10Document3 pagesIn-Thi Hoc Ki 1 Hoa 10nhat hoangNo ratings yet
- Bai Tap Tu Hoc Mon Hoa Lop 10Document5 pagesBai Tap Tu Hoc Mon Hoa Lop 10Trach PhapNo ratings yet
- Ảnh Màn Hình 2023-12-08 Lúc 15.35.29Document22 pagesẢnh Màn Hình 2023-12-08 Lúc 15.35.29Quân đoànNo ratings yet
- De Thi Hoc Ki 1Document15 pagesDe Thi Hoc Ki 1Thị Lê NguyễnNo ratings yet
- Hoa HocDocument14 pagesHoa HocBùi NhộngNo ratings yet
- Hoa HocDocument14 pagesHoa HocBùi NhộngNo ratings yet
- NH Màn Hình 2022-12-05 Lúc 13.05.18Document5 pagesNH Màn Hình 2022-12-05 Lúc 13.05.18Uyên ThuNo ratings yet
- BÀI TẬP CHƯƠNG LIÊN KẾT HOA HOCDocument3 pagesBÀI TẬP CHƯƠNG LIÊN KẾT HOA HOCHoàn TrầnNo ratings yet
- ĐỀ KÌ 1 hóa 10 kết nốiDocument9 pagesĐỀ KÌ 1 hóa 10 kết nốiPhạm Ngọc MaiNo ratings yet
- Đề thi thử số 1 cuối kỳ 1 (22 23)Document2 pagesĐề thi thử số 1 cuối kỳ 1 (22 23)An NguyễnNo ratings yet
- Đề Kiểm Tra Học Kì i Hóa 10Document2 pagesĐề Kiểm Tra Học Kì i Hóa 10Thanh Tung HuynhNo ratings yet
- De Thi Hoc Ki 1 Hoa Hoc 10 KNTT de 4Document4 pagesDe Thi Hoc Ki 1 Hoa Hoc 10 KNTT de 4Tuấn TrầnNo ratings yet
- ĐỀ THPT CHUYÊN LÊ QUÝ ĐÔNDocument17 pagesĐỀ THPT CHUYÊN LÊ QUÝ ĐÔNPhm Ng YennNo ratings yet
- Thi Giua Ki IDocument22 pagesThi Giua Ki Iqueen201No ratings yet
- bộ đề hóa để inDocument20 pagesbộ đề hóa để inPhương LêNo ratings yet
- 2021 2022. Hoa 10 de Cuong HKI 1Document5 pages2021 2022. Hoa 10 de Cuong HKI 1Nhi NguyenNo ratings yet
- Hoá 4Document3 pagesHoá 4Hương BùiNo ratings yet
- BÀI TẬP HÓA ĐẠI VÔ CƠDocument21 pagesBÀI TẬP HÓA ĐẠI VÔ CƠPhùng Anh DuyNo ratings yet
- Ngo I Khóa GDĐPDocument1 pageNgo I Khóa GDĐPBé SôngNo ratings yet
- Tài liệuDocument1 pageTài liệuBé SôngNo ratings yet
- CHỦ ĐỀ 6 Bài soạn TG nghề nghiêp quanh taDocument6 pagesCHỦ ĐỀ 6 Bài soạn TG nghề nghiêp quanh taBé SôngNo ratings yet
- Theo niên giám thống kê y tế 2015Document2 pagesTheo niên giám thống kê y tế 2015Bé SôngNo ratings yet
- Ca SĩDocument1 pageCa SĩBé SôngNo ratings yet
- HSCC RLĐGDocument73 pagesHSCC RLĐGBé SôngNo ratings yet
- TH T Lu NGDocument1 pageTH T Lu NGBé SôngNo ratings yet
- Hoa HC1 Phi PHNG 3Document34 pagesHoa HC1 Phi PHNG 3Bé SôngNo ratings yet
- 2021 CS Co So Ly Thuyet Hoa HocDocument9 pages2021 CS Co So Ly Thuyet Hoa HocBé SôngNo ratings yet
- NônDocument1 pageNônBé SôngNo ratings yet
- Nhóm 1-Phản ứng nổDocument1 pageNhóm 1-Phản ứng nổBé SôngNo ratings yet
- Đề Nhi Y6 - 2Document4 pagesĐề Nhi Y6 - 2Bé SôngNo ratings yet
- Đề 1Document2 pagesĐề 1Bé SôngNo ratings yet
- De 1Document2 pagesDe 1Bé SôngNo ratings yet
- De Thi de Xuat Nop (Phong Chuyen)Document3 pagesDe Thi de Xuat Nop (Phong Chuyen)Bé SôngNo ratings yet
- đề thi hết môn nội y6 trúngtrongnayDocument161 pagesđề thi hết môn nội y6 trúngtrongnayBé SôngNo ratings yet
- Đề 3Document2 pagesĐề 3Bé SôngNo ratings yet
- Đề 2Document2 pagesĐề 2Bé SôngNo ratings yet
- Đề 4Document2 pagesĐề 4Bé SôngNo ratings yet
- TKB Buổi Sáng Từ 05.12.2022Document5 pagesTKB Buổi Sáng Từ 05.12.2022Bé SôngNo ratings yet
- TKB Buổi Chiều Từ 26.12-31.12.2022Document3 pagesTKB Buổi Chiều Từ 26.12-31.12.2022Bé SôngNo ratings yet
- , 1 1 1 0 x x x x : Câu 1: A. B. C. D. Lời giảiDocument22 pages, 1 1 1 0 x x x x : Câu 1: A. B. C. D. Lời giảiBé SôngNo ratings yet
- Hóa 10Document4 pagesHóa 10Bé SôngNo ratings yet
- Đề cương sinh học cuối học kì 1Document5 pagesĐề cương sinh học cuối học kì 1Bé SôngNo ratings yet
- ÔN TÂP-ĐẠI SỐDocument8 pagesÔN TÂP-ĐẠI SỐBé SôngNo ratings yet
- Hoa HocDocument3 pagesHoa HocBé SôngNo ratings yet
- ôn tập học kì 1Document4 pagesôn tập học kì 1Bé SôngNo ratings yet
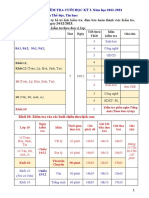
- Kế hoạch kiểm tra học cuối kỳ 1. Năm hoc 2022-2023.Document2 pagesKế hoạch kiểm tra học cuối kỳ 1. Năm hoc 2022-2023.Bé SôngNo ratings yet