Professional Documents
Culture Documents
K.K.& Derivati-12 - 13
Uploaded by
ljdespOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
K.K.& Derivati-12 - 13
Uploaded by
ljdespCopyright:
Available Formats
1
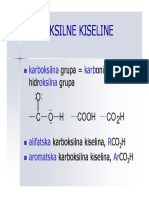
KARBOKSILNE KISELINE
Karboksilne kiseline su organska jedinjenja koja u
svojoj strukturi sadre karboksilnu grupu
(funkcionalna grupa u kojoj je hidroksilna grupa
vezana za karbonilni Catom):
:O:
C ..
OH
..
OPADAJUI PRIORITETI NEKIH
FUNKCIONALNIH GRUPA
Klasa
jedinjenja
Sufiks
Prefiks
-onijum
-onio-
Primer
+
1 Katjoni
Karboksilne -ska
2
kiselina
kiseline
karboksilna
grupa
NH4
amonijum
:O :
karboksi-
..
CH3 C OH
..
etanska k.
:O:
..
CH3 C O
.. C CH3
:O :
karboksilna kiselina
RCOOH
R CO2H
OH
R=H
alkil-grupa
aril-grupa
heterociklicni ostatak
Naziv karboksilna grupa nastaje saimanjem
naziva karbonil i hidroksil.
Podela karboksilnih kiselina
1) U zavisnosti od ugljovodoninog ostatka za koji je
vezana karboksilna grupa razlikujemo:
alifatine k.k. opte formule RCOOH
aromatine k.k. opte formule ArCOOH
heterocikline k.k.
Ako ugljovodonini ostatak sadri nezasienu
vezu, to su nezasiene k.k.
2) Prema broju karboksilnih grupa razlikujemo:
monokarboksilne k. (monokiseline)
dikarboksilne k. (dikiseline)
polikarboksilne k. (polikiseline).
Anhidridi
karb.k.
anhidrid
-ske k.
anhidrid
etanske k.
:O :
4 Estri
alkil-oat
alkoksikarbonil-
..
CH3 C O
.. CH3
metil-etanoat
Alkanoil5
-halogenidi
-oil-halogenid
:O :
..
halogenkarbonil- CH3 C Cl
.. :
etanoil-hlorid
:O :
6 Amidi
-amid
karbamoil-
..
CH3 C NH2
etanamid
7 Nitrili
-onitril
cijano-
CH3CH2 C N :
propanonitril
:O :
8 Aldehidi
-al
formil-
CH3CH2 C H
propanal
:O :
9 Ketoni
-on
okso-
CH3 C CH3
propanon
OPADAJUI PRIORITETI NEKIH
FUNKCIONALNIH GRUPA NASTAVAK
Klasa
jedinjenja
10
Alkoholi
Fenoli
11 Tioli
12 Amini
Sufiks
Prefiks
-ol
hidroksi-
-tiol
merkapto-
-amin
amino-
NOMENKLATURA KARBOKSILNIH KISELINA
Primer
..
CH3CH2CH2 OH
..
1-propanol
..
CH3CH2CH2 SH
..
1-propantiol
CH3CH2CH2
..
NH2
1-propanamin
13 Etri
14 Sulfidi
-etar
-sulfid
alkoksi-
..
CH3CH2 O
.. CH2CH3
oksa-
etoksietan
dietil-etar
alkiltio-
..
CH3 S
.. CH3
tia-
dimetil-sulfid
H
15 Alkeni
-en
alkenil-
CH3
C C
propen
16 Alkini
-in
alkinil-
17 Halogenidi -halogenid halo18 Nitro
19 Alkani
-an
nitroalkil-
CH3 C C CH3
2-butin
..
CH3CH2CH2 Br
.. :
1-brompropan
CH3CH2CH2 NO2
1-nitropropan
CH3CH2CH3
propan
1) Uobiajena (trivijalna) imena ukazuju na
prirodne izvore iz kojih su kiseline prvobitno
izolovane ili na industrijske naine dobijanja.
Kiseline sa razgranatim lancem dobijaju imena od
imena kiselina kojima pripada najdui lanac.
Poloaj supstituenata u odnosu na COOH grupu
se oznaava grkim slovima: , , , itd.
Catom je prvi C do COOH grupe.
Prostije kiseline se mogu posmatrati kao
supstituisane siretne kiseline.
2) IUPACovim sistemom imena k.k. izvode se
dodavanjem zavretka ska kiselina imenu
ugljovodonika sa istim brojem Catoma ukljuujui i
COOH grupu (najdui niz Catoma u kome se
nalazi COOH grupa, a koji ukljuuje najvei broj
drugih funkcionalnih grupa).
Poloaj supstituenata u odnosu na COOH grupu
se oznaava brojevima.
Karboksilni Catom je uvek C1!!!
COOH grupa je funkcionalna grupa najvieg
prioriteta!
Zasiene cikline kiseline imenuju se kao
cikloalkankarboksilne kiseline.
U ovim jedinjenjima i aromatinim k.k. Catom
vezan za COOH grupu je C1!
Dikarboksilne kiseline se imenuju kao dikiseline.
Struktura
IUPAC
ovo ime
Uobiajeno
Izvor
(trivijalno)
(poreklo)
ime
sekret
lezda
metanska mravlja
mrava
HCOOH
kiselina
kiselina
(formica,
lat. mrav)
sire
etanska
siretna
(acetum,
CH3COOH
k.
k.
lat. sire)
mleni
proizvodi
propanska propionska
(pion,
CH3CH2COOH
k.
k.
gr.
mast)
buter
(posebno
butanska buterna
uegli)
CH3(CH2)2COOH
k.
k.
(butyrum,
lat. buter)
koren
pentanska valerijanska
biljke
CH3(CH2)3COOH
k.
k.
valerijana
miris
kozjeg
heksanska kapronska
loja
CH3(CH2)4COOH
k.
k.
(caper,
lat. koza)
Struktura
CH3CH2CHCOOH
CH3
5
CH3
Uobiajeno
(trivijalno) ime
IUPACovo ime
CH3CH2CHCHCOOH
CH3
CH2CH2CHCOOH
CH3
Cl
CH3CHCOOH
OH
CH2COOH
H2C CH
COOH
CH3
H2C C
CH3CH
COOH
CHCOOH
CH CHCOOH
2-metilbutanska -metilbuterna
kiselina
kiselina
2,3-dimetilpentanska k.
,-dimetilvalerijanska k.
4-hlor-2-metilbutanska k.
-hlor--metilbuterna k.
2-hidroksipropanska k.
-hidroksipropionska k.
(mlena k.)
feniletanska k.
fenilsiretna k.
propenska k.
2-metilpropenska k.
2-butenska k.
(cis- i trans-)
3-fenilpropenska k.
(cis- i trans-)
akrilna k.
metakrilna k.
krotonska k.
cimetna k.
OH
CH3CCHCH2CH2COOH
Struktura
CH2CH2CH3
5-butil-6-heptenska kiselina
(ne 5-etenilnonanska kis.)
5-okso-4-propilheksanska kiselina
HOOCCOOH
HOOCCH2COOH
propanmalonska
-dikiselina k.
HOOC(CH2)2COOH
butanilibarna
-dikiselina k.
HOOC(CH2)3COOH
pentanglutarna
-dikiselina k.
COOH
COOH
benzenkarboksilna kiselina
(benzoeva kiselina)
2-aminobenzenkarboksilna kiselina
(o-aminobenzoeva kiselina,
antranilna kiselina)
COOH
H2N
4-amino-2-hidroksibenzenkarboksilna kiselina
Cl
Br
COOH
1-brom-2-hlorciklopentankarboksilna kiselina
O
4-oksocikloheksankarboksilna kiselina
COOH
HOOC(CH2)4COOH
COOH
HOOC
COOH
N
piridin-3-karboksilna kiselina
(nikotinska kiselina)
COOH
COOH
COOH
COOH
1,3(izoftalna kiselina)
heksanadipinska
-dikiselina k.
COOH
COOH
1,2-benzendikarboksilna
kiselina
(ftalna kiselina)
Uobiajeno
Izvor
(trivijalno)
(poreklo)
ime
etanoksalna
-dikiselina kiselina
OH
NH2
COOH
IUPAC
ovo ime
1,4(tereftalna kiselina)
HOOC
(oksus, lat.
otar,
kiselo)
oksidacija
jabune k.
(acidum
malicum)
destilat
ilibara
(succinum,
lat. ilibar)
oksidacija
masti ili
masnih k.
(adeps, lat.
mast)
cis-2maleinska
butenk.
-dikiselina
trans-2fumarna
butenk.
-dikiselina
biljka
fumaria
(fumus, lat.
dim)
STRUKTURA I FIZIKE OSOBINE
KARBOKSILNIH KISELINA
10
Jedinjenje CH3CH2COOH CH3(CH2)2CH2OH CH3(CH2)3CH3
Tklj (C)
1,097 A
H
111 o
124,1 o
1,202 A
141
118
36
Nie k.k. su dobro rastvorne u vodi zbog
mogunosti obrazovanja intermolekulskih
vodoninih veza sa molekulima vode:
124,9 o
1,343 A
O
o
0,972 A
106,3 o
Molekulska struktura mravlje kiseline
Planaran molekul sa priblinim rasporedom
jednakostranicnog trougla oko karbonilnog C.
K.k. su POLARNA jedinjenja prisustvo
polarizovane karbonilne i hidroksilne grupe!
K.k. imaju veoma visoke Tt i Tklj zbog mogunosti
obrazovanja intermolekulske vodonine veze u
vrstom i tenom stanju dimeri:
..
..O.. . . . . . . . H O:
C R
R C
.
.
.
.
.
.
.
.
.
:O
.O..
.. H
dimer
Tklj k.k. su:
vie od Tklj UGLJOVODONIKA sline
molekulske mase (RCOOH su polarna jedinjenja)
vie od Tklj ALKOHOLA sline molekulske mase
(RCOOH grade jae vodonine veze).
H
..
..O... . . . . . . H .O
.
R C
..
. . . . . ....O H
:O
.. H
H
Rastvorljivost opada sa poveanjem hidrofobnog
dela moleklula granica rastvorljivosti je kod k.k. sa
5 Catoma.
Kiseline sa:
13 Catoma tenosti otrog mirisa, dobro
rastvorne u vodi,
49 Catoma uljaste tenosti, neprijatnog
mirisa, slabo rastvorne u vodi,
10 i vie Catoma vrste supstance,
nerastvorne u vodi, bez mirisa usled male
isparljivosti.
11
SINTEZA KARBOKSILNIH KISELINA
1. Reakcije oksidacije
Najvaniji postupci za dobijanje k.k. posebno u
industrijskim razmerama.
12
1.2. Nezasienih ugljovodonika
Energina oksidacija niz Catoma se raskida na
mestu gde se nalazi nezasiena veza.
1.1. Primarnih alkohola i aldehida
2-penten
Direktno iz alkohola ili iz aldehida oksidacijom se dobija
kiselina sa istim brojem Catoma.
RCH2
OH
[O]
RCHO
[O]
RCOOH
R = alkil- ili aril-grupa
CH2CH3
CH3(CH2)3CHCH2OH
CH3(CH2)3CHCOOH
NaOH/H2O
2-etil-1-heksanol
b) CrO3/H2SO4
c) KMnO4/H2SO4 ili NaOH/H2O
(kisela ili bazna sredina)
d) HNO3
CH2CH3
KMnO4
2-etilheksanska k.
Oksidacija 1 alkohola u prisustvu Cornforth-ovog
reagensa (PDC = piridinijum-dihromat):
C H3
C H3
CH3C=CHCH2CH2CHCH2CHO
C CCH3
PDC katalizator = piridinijum-dihromat
etanska k.
(sircetna k.)
CrO3 +
C H3
[O]
ArCOOH
[O] a) K2Cr2O7/H2SO4
b) KMnO4/H2SO4 ili NaOH/H2O
(kisela ili bazna sredina)
c) razbl. HNO3
CH3C=CHCH2CH2CHCH2CH2OH
3,7-dimetil-6-oktenol
PDC
DMF
C H3
+ H2O
Benzilni poloaj!!!
C H3
N+
H
O
O
- O Cr O Cr O O
N+
3,7-dimetil-6-oktenska k.
COOH
CH3
KMnO4
H+ ,
Cr(VI)-reagens je selektivn
ne oksiduje C C i C C
C H3
CH3C=CHCH2CH2CHCH2COOH
COOH
CH3COOH +
3,7-dimetil-6-oktenal
PDC
CH2Cl2
propanska k.
(propionska k.)
1.3. Alkilbenzena (arena)
Energina oksidacija alifatini boni niz
alkilbenzena je osetljiv na oksidaciju bez obzira na
veliunu.
Ovum procesom se raskidaju veze u benzilnom
poloaju:
Ar
Cornforth-ov reagens
KMnO4
H+ ,
CH3COOH + CH3CH2COOH
1-propinilbenzen
[O] a) K2Cr2O7/H2SO4
karboksilna
kiselina
aldehid
1o alkohol
KMnO4
H+ ,
CH3CH CHCH2CH3
Primarni alkoholi (RCH2OH) oksiduju se do:
aldehida (RCHO) u prisustvu CH2Cl2
karboksilnih kiselina (RCOOH) u prisustvu DMF.
Neovisno do vrste rastvaraa, alilni- i benzilni 1
alkoholi oksiduju se do aldehida.
CH2CH3
1-etil-3-metilbenzen
COOH
1,3-benzendikarboksilna k.
(izoftalna k.)
13
(CH3)2CH
C(CH3)3
K2Cr2O7/H2SO4
1-terc-butil-4-izopropilbenzen
HOOC
C(CH3)3
4-terc-butilbenzenkarboksilna k.
(p-terc-butilbenzoeva k.
14
CH3CH2CH2CH2Br
NaCN
SN2
1-brombutan
CH3CH2CH2CH2CN
pentanonitril
OH /H2O
CH3CH2CH2CH2COO
so pentanske k.
+
H /H2O
Panja: CN je jaka baza - RX mora biti 1o!
COOH
CH3
razbl HNO3
1,2,3,4-tetrahidronaftalen
COOH
1,2-benzendikarboksilna k.
(ftalna k.)
1.4. Ketona
Energina oksidacija dolazi do raskidanja veze
sa obe strane karbonilne grupe nastaje smea
proizvoda.
O
CH3CH2
a
CH2CH2CH2CH3
C
b
HNO3,
CH3COOH + CH3(CH2)3COOH
ili
KMnO4/H2SO4,
H3C C Br
CH3
CH2Cl
(hlormetil)benzen
(benzil-hlorid)
H3C
2-metilpropen
CH2CN
NaCN
CH2COOH
+
H /H2O
feniletanska k.
(fenilsircetna k.)
feniletanonitril
(fenilacetonitril)
CH3
CH3
(o-toluidin)
b
pentanska k.
C CH2
+
CH3CH2COOH + CH3(CH2)2COOH
3-heptanon
E2
2-brom-2-metilpropan
(terc-butil-bromid)
NH2
NaCN
CH3CH2CH2CH2COOH
H3C
NaNO2, HCl, H2O
0-5 oC
+ N2 Cl
(o-toluendiazonijum-hlorid)
CH3
CN
CuCN
(o-tolunitril)
2. Hidroliza nitrila
Alifatine i aromatine k.k. se mogu dobiti iz nitrila.
+
H /H2O
R CN
ili
Ar
CN
OH /H2O
+
H /H2O
CH3
COOH
R COOH + NH4
Ar
ili
COOH
R COO + NH3
ili
Ar COO
2-metilbenzenkarboksilna k.
(o-metilbenzoeva k.)
15
3. Karboksilovanje Grignardovih reagenasa
Grignardovi reagensi reaguju sa ugljendioksidom
(CO2) veoma slino kao sa karbonilnim jedinjenjima.
Reakcija se izvodi:
uvoenjem gasovitog CO2 u etarski rastvor
Grignardovog reagensa ili
izlivanjem Grignardovog reagensa na "suvi
led" (vrst CO2).
Nastaje so k.k. koja protonovanjem sa razbl.
mineralnom kiselinom daje k.k.
..
:O
MgX +
aps. etar
ili
Ar
ili
Ar
+
H /H2O
- XMgOH
:O
:
_
Grignard-ov
reagens
Br
ili
Ar
- +
COO MgX
COO + MgBr
MgBr
COOH
COOH
+
H /H2O
CO2
Mg
aps. etar
1-brom-4-(1-metilpropil)benzen
(p-brom-sek-butilbenzen)
Cl
Mg
aps. etar
4-(1-metilpropil)benzenkarboksilna k.
(p-sek-butilbenzoeva k.)
MgCl
2-hlor-2-metilbutan
RX moe biti 1o, 2o ili 3o alkil-halogenid!
CO2
R CCl3
COO
-+
MgCl
+
H /H2O
OH , H2O
OH
ili
Ar
- H2O
R C OH
R COOH
ili
OH
CCl3
Ar
COOH
ili
Ar
C(OH)3
HO
CH3
Cl2
h
ili
CCl3
trihlormetilbenzen
(benzo-trihlorid)
OH , H2O
OH
OH
fenilmetantriol
COOH
- H2O
benzenkarboksilna k.
(benzoeva k.)
5. Hidroliza derivata karboksilnih kiselina
K.k. se mogu dobiti hidrolizom svojih derivata.
R COOH
so karboksilne kis.
MgX
4. Hidroliza trihalogenskih derivata
Reaguju trihalogenski derivati alkana i arena.
metilbenzen
(toluen)
.. : O: +MgX
R
16
COOH
2,2-dimetilbutanska k.
17
HEMIJSKE OSOBINE KARBOKSILNIH KISELINA
Kiselost
Najvanija osobina k.k. je njihova kiselost.
Jonizacija k.k. u vodenom rastvoru:1
RCOOH + H2O
kiselina
Ke
baza
RCOO- + H3O+
konjugovana konjugovana
kiselina
baza
U stanju ravnotee, izraz za Ke je:
Ke =
[RCOO- ] [H3O+]
[H2O] [RCOOH]
Izraz za konstantu kiselosti,Ka je:2
Ka = [H2O]Ke =
[RCOO- ] [H3O+]
[RCOOH]
Merilo za jainu kiselosti:
Ka (to je vrednost Ka vea, kiselost je vea),
pKa = logKa (to je vrednost pKa manja,
kiselost je vea).
Za k.k. Ka 104105 (pKa 45).
1
U vodenom rastvoru molekul k.k. (RCOOH, nejonizovani
molekul) je u ravnotei sa karboksilatnim anjonom (RCOO) i
protonom (H+), odnosno, hidronijum jonom (H3O+).
Kiselost k.k. izraena je ovom jednainom (jonizacija k.k. u
vodenom rastvoru) i odgovarajuom konstantom ravnotee Ke.
2
Kako se radi o razblaenom vodenom rastvoru (k.k. slabo
jonizuje), to se moe uzeti da je [H2O] = const.
18
K.k. su kiselije od ostalih organskih jedinjenja koja
imaju kiseli Hatom:
RCOOH > H2O > ROH > HCCH > NH3 > RH
Vano:
K.k. su kisele mogu da disoju i daju H+.
K.k. su kiselije od ostalih organskih
jedinjenja koja imaju kiseli Hatom u
COOH grupi polarizacija C=O u neposrednoj
blizini OH grupe olakava disocijaciju!
Vrednosti Ka k.k. se razlikuju na
ravnoteu, koja je kvantitativno izraena
vrednou Ka, utie struktura kiseline.
Struktura i kiselost k.k.
Stabilnost molekula i jona zavisi od strukture i
elektronskih efekata!
RCOOH + H2O
Ke
RCOO- + H3O+
Stanje ravnotee zavisi od razlika u relativnoj
stabilnosti nejonizovane k.k. i karboksilatnog jona.
Ravnotee e biti pomerena "" (u pravcu
jonizacije kiseline) utoliko vie ukoliko je:
stabilnost k.k. u nejonizovanom stanju manja
(njena sposobnost da jonizuje vea),
stabilnost nastalog karboksilatnog jona vea
(njegova tenja za primanjem H+ manja).
19
slabo kiseo
H
R C O
R C
+
H
alkohol
jako kiseo
karboksilna kiselina
pKa = 4-5
pKa = 16-18
20
Molekul k.k.
U nedisosovanom molekulu k.k. deluju 2
elektronska efekta:
induktivni efekat (I) znaajan
(destabilizuje molekul k.k.)
Disocijacija kod alkohola (slaba disocijacija):
ROH
RO + H +
Disocijacija kod k.k.:
..
O:
..
O
..
.. :O:
+
O
..
k.k.
neekvivalentne
rez. strukture
..
O
..
karboksilatni
anjon
ekvivalentne
rez. strukture
Jak -I efekat + karbonilnog C-atoma
smanjuje stabilnost nedisosovanog molekula kiseline
jer olakava izdvajanje H+
k.k.
rezonancioni efekat (el. par sa O se pomera
du veze) manje znaajan
(ide na ruku I efektu jer omoguava lake
izdvajanje H+)
..
O:
.. O
.. :
+ H+
.. :O:
R C
+
I za alkohol i za alkoksidni jon postoji samo po
jedna struktura nema stabilizacije!
..
O:
.. :O:
..
O
..
k.k.
neekvivalentne rez. strukture
(razdvajanje naelektrisanja)
.. :O:
+
O
..
+
O
..
Na kiseoniku je "+" ara
to olakava izdvajanje H+
21
Karboksilatni anjon
..
O:
.. :O:
C .. R + O
.. :
C .. _
R + O
..
R C
R C
O
1/2
o
p orbitala sa C
se preklapa jednako sa
p orbitalama sa dva O
(4 e- su rasporedjena
na 3 atoma)
1,20 A
1,26 A
O
H C
o
1,36 A
O
_
H C
OH
1,26 A
Na +
akceptori
elektrona
O
_
Stabilnost karboksilatnog anjona jako poveana
stabilizacija rezonancijom (oslobaa se E).
"" ara je ravnomerno rasporeena
(delokalizovana) na oba Oatoma.
Da bi se H+ ponovo asocirao treba dovesti E
ekvikalentnu E rezonancije!
O
Uticaj supstituenata na kiselost k.k.
Kiselost k.k. poveavaju faktori koji poveavaju
stabilnost karboksilatnog anjona vie nego
stabilnost kiseline!
karboksilatni anjon
ekvivalentne rez. strukture
1/2
22
(stabilizuju anjon)
povecavaju kiselost k.k.
donori
elektrona
(destabilizuju anjon)
smnjuju kiselost k.k.
1. ALIFATINE K.K.
Kiselina
HCOOH
mravlja
CH3COOH
siretna
ClCH2COOH
hlorsiretna
Cl2CHCOOH
dihlorsiretna
Cl3CCOOH
trihlorsiretna
O2NCH2COOH
nitrosiretna
hidroksisiretna
HOCH2COOH
(glikolna)
pKa
3,75
4,76
2,87
1,25
0,65
1,68
3,83
23
O
H
C
+
CH2
Cl
mravlja k.
pKa = 3,75
CH3
C
+
24
formijatni jon
sircentna k.
pKa = 4,76
+ CH3
C
+
+ Cl
C
O
acetatni jon
Molekul sretne k. je stabilniji od molekula
mravlje: prisutna CH3 grupa svojim +I efektom
smanjuje + na karbonilnom C (on slabije povlai e
du veze).
Stabilnost acetatnog jona je smanjena (poveana
je njegova baznost) u odnosu na formijatni: prisutna
CH3 grupa svojim +I efektom poveava "" aru na
karbonilnom C (ceo anjon je destabilizovan i
olakano je vezivanje H+).
CH3COO je jaa baza od HCOO, pa je
HCOOH jaa kiselina od CH3COOH!
CH2
hloracetatni jon
hlorsircentna k.
pKa = 2,87
_
O
Molekul hlorsretne k. je manje stabilan od
molekula mravlje: prisutni Cl svojim I efektom
poveava + na karbonilnom C (on jae povlai e
du veze).
Stabilnost hloracetatnog jona je poveana
(smanjena je njegova baznost) u odnosu na
formijatni: usled I efekta Cl "" ara nije
skoncentrisana samo na atomima O nego je
delimino rasprena i na ostale atome u nizu.
ClCH2COO je slabija baza od HCOO, pa je
ClCH2COOH jaa kiselina od HCOOH!
:O :
O
+
N
_
:O
.. :
CH2
C
+
nitrosircentna k.
pKa = 1,68
_
O
:O :
+
N
_
:O
.. :
CH2
anjon nitrosircetne k.
Anjon nitrosiretne k. je stabilniji (slabija baza) od
anjona hlorsiretne k.: NO2 grupa je zbog "+" are
na N elektronegativnija (jai I) i jae privlai e od
Cl.
O2NCH2COO je slabija baza od ClCH2HCOO, pa
je O2NCH2COOH jaa kiselina od ClCH2COOH!
25
O
HO
CH2
2. NEZASIENE ALIFATINE K.K.
C
+
hidroksisircentna k.
pKa = 3,83
26
O
O
HO
CH2
anjon hidroksisircetne k.
Anjon hidroksisiretne k. je stabilniji (slabija baza)
od anjona siretne k.: usled I efekta OH grupe ""
ara nije skoncentrisana samo na atomima O nego
je delimino rasprena i na ostale atome u nizu.
HOCH2COO je slabija baza od CH3COO, pa
je HOCH2COOH jaa kiselina od CH3COOH!
Induktivni efekat opada sa rastojanjem (gotovo je
zanemarljiv ako se njegov uticaj posmatra preko vie
od 4 C atoma).
Kiselina
pKa
CH3CH2CH2COOH
buterna
4,82
CH3CH2CH(Cl)COOH -hlorbuterna
2,86
CH3CH(Cl)CH2COOH -hlorbuterna
4,05
ClCH2CH2CH2COOH -hlorbuterna
4,53
Poredak kiselosti halogen supstituisanih k.k. sline
strukture je u skladu sa relativnim I efektom atoma
halogena (vea elektronegativnost jai I efekat)!
Kiselina
pKa
FCH2COOH
fluorsiretna
2,56
ClCH2COOH
hlorsiretna
2,87
BrCH2COOH
bromsiretna
2,9
ICH2COOH
jodsiretna
4,17
Kiselost k.k. zavisi od vrste hibridizacije Catoma
za koji je vezana COOH grupa!
Hibridna
orbitala
Udeo s
orbitale
sp3
1/4
sp2
1/3
sp
1/2
to je u hibridnoj orbitali
vei udeo sorbitale
elektroni su blie jezgru
(javlja se induktivan efekat
privlaenja elektrona ka
jezgru Catoma).
Elektronegativnost hibridizovanih Catoma
opada u nizu: Csp > Csp2 > Csp3
CH3CH2
COOH
sp3
H2C CH
Kiselina
propionska
pKa
4,78
akrilna
4,25
propiolna
1,79
COOH
sp2
HC C
COOH
sp
Akrilna k.: nasuprot I efektu Csp2 deluje +R
efekat (poveana el. gustina na karbonilnom O) koji
smanjuje kiselost:
..
O:
H2C CH
C OH
+
.. _
: O:
+
CH2
CH
C OH
+R efekat C=C veze
Meutim, kako I efekat Csp2 preovlauje nad +R ef.
C=C veze, akrilna k. je ipak neto jaa k. od propionske.
Propiolna k.: +R efekat postoji i kod CC veze ali je
zanemarljiv u odnosu na jak I efekat Csp.
27
3. BENZOEVA
I SUPSTITUISANE BENZOEVE K.
U nedisosovanom molekulu benzoeve k. deluju 2
elektronska efekta:
induktivni efekat (I) Csp2 poveava kiselost
(olakava izdvajanje H+ destabilizuje molekul)
sp2
C
+
pKa = 4,20
rezonancioni efekat (+R) benzenovog prstena
smanjuje kiselost
(poveana el. gustina na karbonilnom O i tako
oteava izdvajanje H+ stabilizuje molekul)
..
O:
C
.. : O:
OH
OH
.. : O:
+
.. : O:
OH
OH
Vano: Da bi dolo do
rezonancije COOH grupa
i fenilno jezgro moraju biti u
koplanarnom poloaju!
.
.
C
OH
28
Benzoeva kiselina je jaa kiselina od svog
zasienog analoga: cikloheksankarboksilne
kiseline!
COOH
COOH
sp3
pKa
4,87
<
sp2
4,20
Cikloheksankarboksilna k.
COOH grupa je vezana za Csp3 cikloheksilgrupa je donor elektrona (+I) ka COOH grupi.
Benzoeva k.
COOH grupa je vezana za Csp2 zbog Csp2
preko koga je vezana za COOH grupu, fenilgrupa je ovde, poput C=C veze (npr. kod akrilne
k.) slabiji elektron donor ka COOH grupi nego
zasieni (Csp3) Catom
I efekat Csp2 preovlauje nad +R
efektom!
29
COOH
..
:O
pKa
O
C
N
_
Supstituent
p-
4,20
NO2
3,44
OH
4,58
:O
.. :
-I efekat NO2 grupe
..
HO
..
-I efekat OH grupe
p-nitrobenzoeva k.
..
:O
N
_
_ ..
:O :
: O:
+
OH
_
:O
.. :
-R efekat NO2 grupe
..
:O
+
_
:O
.. :
:O
.. :
OH
narocito povoljno!
(povecanje + na karb. C-atomu)
_ ..
:O :
O
N+
: O:
N
_
:O
.. :
..
HO
..
OH
+R efekat OH grupe
O
H
..
HO
..
narocito
povoljno!
HO
..
OH
(povecana el. gustina na
karb. O)
HO
..
Ka1
COOH
+
H +
OOC
COOH
pentan-dikiselina
Ka2
.. _
: O:
..
O:
C
HOOC
anjon p-nitrobenzoeve k.
(-R i -I ef. NO2 grupe deluju u istom smeru)
p-hidroksibenzoeva k.
pKa1
pKa2
HOOCCOOH
oksalna
1,27
4,28
HOOCCH2COOH
malonska
2,85
5,70
HOOC(CH2)2COOH
ilibarna
4,19
5,64
HOOC(CH2)3COOH
glutarna
4,35
5,42
Dikarboksile k. imaju 2 Ka pri emu je Ka1 > Ka2
(tee je ukloniti H+ iz anjona nego iz neutralnog
molekula)
4. DIKARBOKSILNE K.
Dikarboksilne k. koje imaju COOH grupe na
krajevima ugljovodoninog lanca:
Kiselina
30
anjon p-hidroksibenzoev k.
narocito nepovoljno!
(+R i -I ef. OH grupe deluju u suprotnim smerovima, +R je daleko jaci)
p-Nitrobenzoeva k. je jaa od p-hidroksibenzoeve k. jer je
molekul p-nitrobenzoeve k. manje stabilan,
anjon p-nitrobenzoeve k. stabilniji.
OOC
COO
Dve COOH grupe meusobno utiu jedna na
drugu svojim I efektom (sa rastojanjem se
smanjuje).
Jak I efekat jedne COOH grupe omoguava
lake odvajanje H+ iz druge.
C
+
O
C
+
O
O
CH3COOH
HOOC COOH
C
+
C
+
pKa = 4,76 (Ka = 1,75 x 10-5)
pKa1 = 1,27 (Ka1 = 5400 x 10-5)
pKa2 = 4,28 (Ka2 = 5,2 x 10-5)
31
KARAKTERISTINE REAKCIJE K.K.
1. Reakcije zamene (supstitucije) protona
KISELOST
Nastaju soli k.k. sve su rastvorne u vodi!
1.1. Reakcije sa metalima
(CH3COO)2 Zn
2CH3COOH + Zn
etanska k.
(sircetna k.)
+ H2
cink-etanoat
(cink-acetat)
2H+ + Zn
H2 + Zn
2+
CH3COOH + NaOH
..
H3C C O
..
CH3COO
-+
Na
natrijum-etanoat
(natrijum-acetat)
etanska k.
(sircetna k.)
H2O
2-
2H
Bikarbonatni test:
CH3COOH + NaHCO3
H
+ HCO3
2CH3COONa + CO2
CO2
H2CO3
+ CO3
H2O
H2CO3
: O:
+ : NH3
: O:
+ H2O
..
H C O
..
+ H2O
..
CH3NH2
metilamin
: O:
.. +
:
NH
CH
H C O
3
3
..
metilamonijum-metanoat
(metilamonijum-formijat)
: O:
: O:
..
C O
..
.. - +
H3C C O
.. : NH4
amonijum-etanoat
(amonijum-acetat)
+ H2O
1.3. Reakcije sa karbonatima i bikarbonatima
2CH3COOH + Na2CO3
1.4. Reakcije sa amonijakom i derivatima
amonijaka
Baze poput amonijaka i njegovih derivata (amina
(1, 2, 3), hidroksilamina, hidrazina) reaguju sa
k.k. dajui odgovarajue soli ne adiraju se na
karbonilnu grupu kao kod aldehida i ketona.
Ova jedinjenja su istovremeno baze i nukleofili ali
se prenos protona (deprotonovanje) odigrava bre
nego nukleofilni napad!
: O:
1.2. Reakcije sa hidroksidima
H2O
32
+ : NH2OH
hidroksilamin
.. - +
: NH3OH
C O
..
hidroksilamonijum-benzoat
CH3COONa + CO2
CO2
+ H2O
+ H2O
Reakcija k.k. sa bikarbonatima (bikarbonatni test)
je karakteristina za k.k.
Za razliku od k.k. fenoli pokazuju negativan
bikarbonatni test!
CH3CH2CH2COOH
+ H2N NH2
hidrazin
CH3CH2CH2COO
+
H3NNH2
hidrazinijum-butanoat
(hidrazinijum-butirat)
33
2. Redukcija sa litijum-aluminijumhidridom
(LiAlH4)
Nastaju 1 alkoholi.
1) LiAlH4, THF
2) H +, H O
RCOOH
34
3. Dekarboksilacija
Izdvajanje molekula CO2 iz molekula k.k.
O
R
RCH2OH
ili
COOH
1) LiAlH4
2) H +, H O
CH2OH
CH3
CH3
3-metilbenzenkarboksilna k
(m-metilbenzoeva k.)
COOH
+ O C O
ili
Ar
ugljovodonik
CH3COO + Na
NaOH, CaO
CH4 + CO2
COO + Na
CH2OH
NaOH, CaO
2-cikloheksenkarboksilna k.
R H
Pri dekarboksilovanju k.k. ugljovodonini ostatak
prima H+ iz COOH grupe, uz nastajanje
odgovarajueg ugljovodonika i izdvajanje CO2.
Reakcija se esto vri destilacijom soli k.k. u
prisustvu "natron krea" (smea NaOH i CaO).
(3-metilfenil)metanol
(m-metilbenzil-alkohol)
1) LiAlH4
2) H +, H O
kat.
ArCOOH
ArCH2OH
1o alkohol
ili
ili
ArCOOH
2-cikloheksenilmetanol
CO2
natrijum-benzoat
Zapravo se deava dekarboksilovanje
karboksilatnog anjona.
O
R
.. O
.. :
R:
+ CO2
R H
to je kiselina jaa, jae disocira, daje stabilniji
karboksilatni anjon dekarboksilacija je bra.
35
Izuzetno lako se dekarboksiluju npr. trihlorsiretna
i 2,4,6-trinitrobenzoeva k. veoma su jake k.
Cl
Cl
C COOH
Cl
oC
Cl
Cl
CO2
trihlormetan
C COO
Cl
C H +
CO2
stabilan
karboksilatni anjon
COOH
NO2
O2N
H2O
Imenuju se promenom imena alkanske kiseline iz
koje nastaju u ALKANOIL-HALOGENID.
Halogenidi cikloalkankarboksilnih kiselina zovu se
CIKLOALKANKARBONIL-HALOGENIDI.
NO2
O2N
CO2
Cl
NO2
O2N
NO2
3-metilbutanoil-bromid
O
COO
COOH
etanoil-hlorid
(acetil-hlorid)
pentanoil-hlorid
1,3,5-trinitrobenzen
NO2
O2N
+
H +
Cl
NO2
O2N
+
NO2
CH3CHCH2CBr
CH3CCl
NO2
NO2
CH3
100 oC
2,4,6-trinitrobenzenkarboksilna k.
(2,4,6-trinitrobenzoeva k.)
R = alkil- ili aril-grupa.
Cl
Cl
Cl
X = F, Cl, Br, I
Cl
Cl
+
H + Cl
C COOH
C H +
Cl
trihlorsircetna k.
Cl
DOBIJANJE DERIVATA K.K.
1. Alkanoil-halogenidi (halogenidi k.k.)
Cl
H2O
100
36
NO2
stabilan
karboksilatni anjon
4. Konverzija u derivate k.k.
Iz k.k. se mogu dobiti njihovi derivati: alkanoilhalogenidi, anhidridi, estri, amidi.
CO2
benzoil-jodid
cikloheksankarbonil-hlorid
Najznaajniji predstavnici su alkanoil-hloridi.
Dobijaju se delovanjem hlorida mineralnih kiselina
na k.k..
SOCl2
RCOOH
ili
ArCOOH
PCl5
PCl3
Cl ili Ar
Cl
37
SOCl2
CH3COOH
etanska k.
(sircenta k.)
38
Dobijanje anhidrida
2.1. Reakcijom k.k. sa alkanoil-hloridima
CH3COCl
etanoil-hlorid
(acetil-hlorid)
benzoil-hlorid
Mogu se dobiti prosti (R = R') ili meoviti (RR')
anhidridi.
O O
2. Anhidridi k.k.
CH3COOH + CH3COCl
O
R
O
O
etanoil-hlorid
(acetil-hlorid)
etanska k.
(sircetna k.)
Imenuju se dodajui izraz ANHIDRID imenu
kiseline (ili imenima, u sluaju meovitih).
O O
CH3COCCH3
anhidrid
etanske k.
anhidrid
2-buten-dikiseline
(anhidrid maleinske k.
maleinanhidrid)
CH3COCCH3
anhidrid
etanske k.
(acetanhidrid)
RCO
O
-+
O O
RCOCR' + Na+ Cl
Na + ClCR'
Mogu se dobiti prosti (R = R') ili meoviti (RR')
anhidridi.
O
O
anhidrid
etanske i propanske k.
(anhidrid sircetne k.,
acetanhidrid)
2.2. Reakcijom Na-soli k.k. sa alkanoil-hloridima
R = alkil- ili aril-grupa.
RCOCR' + HCl
COCl
benzenkarboksilna k.
(benzoeva k.)
RCOH + ClCR'
PCl3
COOH
O O
O
O
O
anhidrid
1,2-benzendikarboksilne k.
(anhidrid ftalne k.,
ftalanhidrid)
CH3COO
-+
Na + Cl
natrijum-etanoat
(natrijum-acetat)
H3C C O C
(anhidrid
sircetne i benzoeve k.)
benzoil-hlorid
2.3. Reakcijom k.k. sa acetanhidridom
O
O O
2RCH2COH + CH3COCCH3
acetanhidrid
(dehidrataciono
sredstvo)
O O
RCH2COCCH2R + 2CH3COOH
39
COOH + (CH3CO)2O
O
+ 2CH3COOH
C O C
anhidrid benzenkarboksilne k.
(benzanhidrid)
benzenkarboksilna k.
(benzoeva k.)
2CH3CH2COOH + (CH3CO)2O
propanska k.
O
CH3CH2
C O C CH3CH2 + 2CH3COOH
2.4. Dobijanje ciklinih anhidrida
Zagrevanjem dikarboksilnih kiselina
(intramolekulska dehidratacija) dobijaju se ciklini
anhidridi.
Nastaju stabilni peto ili estolani prstenovi.
anhidrid propanske k.
CH3COOH
etanska k.
(sircetna k.)
AlPO4
700 oC
H2C
+ CH3COOH
O + H2O
H2C
H2O + H2C
COH
etenon
(keten)
H2C
O
oksa-2,5-ciklopentandion
anhidrid butan-dikiseline
(anhidrid cilibarne k.)
O
butan-dikiselina
(cilibarna k.)
OH
C
COH
Acetanhidrid se dobija iz ketena:
H2C
40
O
O
CH3
OH
adicija sircetne k. na
karbonilnu grupu ketena
O + H2O
OH
O O
CH3COCCH3
anhidrid etanske k.
(acetanhidrid)
anhidrid
1,2-benzendikarboksilne k.
1,2-benzendikarboksilna k.
(ftalna k.)
(anhidrid ftalne k.)
(ftalanhidrid)
O
COOH
COOH
pentan-dikiselina
(glutarna k.)
+ H2O
O
oksa-2,6-cikloheksandion
anhidrid pentan-dikiseline
(anhidrid glutarne k.)
41
3. Estri k.k.
O
R
R'
R, R' = alkilili aril-grupa
Imenuju se kao ALKIL-ALKANOATI.
Uobiajeno (trivijalno) ime ciklinih estara je
LAKTON, a po IUPACu su to OKSA-2CIKLOALKANONI.
O
C
O
O
3-metilbutil-etanoat
(izopentil-acetat)
metil-(2-amino)benzoat
(metil-antranilat)
oksa-2-ciklobutanon
(-propiolakton)
CH3
NH2
O1
5-metiloksa-2-ciklopentanon
(-valerolakton)
Dobijanje estara
3.1. Reakcijom k.k. sa alkoholima
ESTERIFIKACIJA
Kiselokatalizovana rekcija katalizator H+ jon.
Bez prisistva H+ reakcija je jako spora!!!
RCOOH + R'OH
RCOOR' + H2O
42
"" ESTERIFIKACIJA!
"" HIDROLIZA estra!
Ravnotea moe da se pomeri prema estarskom
proizvodu:
korienjem vika jednog od reaktanata
(alkohol se uzima u viku) ili
selektivnim uklanjanjem jednog od proizvoda
iz reakc. smee.
U stanju ravnotee izraz za konstantu ravnotee
esterifikacije, Ke, je:
v1 = v2
k1[RCOOH][R'OH] = k2[RCOOR'][ H2O]
1 K RCOOR'H2 O
e RCOOHR' OH
k
2
k
Protoni (H+) kao katalizator ubrzavaju postizanje
ravnotee istovremeno ubrzavaju i esterifikaciju i
hidrolizu!
O
H3C
O
OH
etanska k.
(sircetna k.)
+ CH3CH2
OH
etanol
(etil-alkohol)
H3C
OCH2CH3 + H2O
etil-etanoat
(etil-acetat)
Reakcija esterifikacije spada u
reakcije nukleofilne acilne supstitucije.
Esterifikacija je kiselokatalizovana
adicionoeliminaciona reakcija!!!
O
R C
acil grupa
43
Mehanizam ESTERIFIKACIJE (kiselakataliza)
Faza 1: protonovanje karboksilne grupe
: O:
R
C ..
+
O
.. H - H
.. H
:O
.. H
:O
+ H
:O
+ H+
C ..
O
.. H
C ..
R + O
.. H
C +
O
.. H
karbokatjon stabilizovan rezonancijom
(aktivirana karbonilna grupa za napad nukleofila)
Faza 2: nukleofilni napad alkohola (adicija)
+ H
:O
..
C ..
+ R'OH
..
O
R
.. H
.. H
:O
..
R C O
.. H
O
..
R' + H
+
-H
+ H+
.. H sp3
:O
..
R C O
.. H
:
O
..
R'
tetraedarski intermedijer
Tetraedarski intermedijer je kjuan podlee
kiselokatalizovanom razlaganju u oba smera:
protonovanjem O alkoksi grupe (R'O)
indukuje se eliminacija alkohola reversnim
redosledom faza 1 i 2,
protonovanjem bilo kojeg O hidroksilne grupe
(OH) uz eliminaciju H2O nastaje estar (faza 3).
Faza 3: eliminacija vode
.. H
:O
+ H+
..
R C O
.. H
+
-H
:
O
..
R'
+ H
:O
R
C ..
O
.. R'
.. H
:O
H
R C O :+
H
O
.. :
R'
.. H
:O
- H 2O
+ H 2O
C ..
R + O
.. R'
protonovani estar
.. H
:O
R
: O:
+
-H
C +
+ H+
O
.. R'
C ..
O
.. R'
estar
44
Uloga kiselog katalizatora, protona:
aktivira karbonilnu grupu za nukleofilni napad
alkohola (faza 2),
transformie hidroksilnu grupu (loa odlazea
grupa) u dobru odlazeu grupu, vodu (faza 3).
Sve faze su povratne te dodatak vika alkohola ili
uklanjanjem vode ili estra iz reakc. smee, pomera
ravnoteu u desno u fazama 2 i 3.
Hidroliza estra vri se reversnom reakcijom i
favorizovana je u prisustvu vode.
Kiselokatalizovana hidroliza estra je adiciono
eliminaciona reakcija nukleofil je H2O, a eliminie
se alkohol.
I esterifikacija i hidroliza estra su reakcije
veoma osetljive na uticaj sternih faktora
voluminozne grupe u molekulu kiseline i
alkohola, odnosno, estra!
Reaktivnost u reakciji esterifikacije:
za alkohole: CH3OH > 1 > 2 > 3
za k.k.: HCOOH > CH3COOH > RCH2COOH >
> R2CHCOOH> R3CCOOH
45
3.2. Intramolekulska dehidratacija - i -hidroksi
kiselina sinteza ciklinih estara (laktona)
1
H2C
3
COH
H2C
H2SO4, H2O;
O
H2C
H2C
H2SO4, H2O;
OH
CH2
4
COH
CH2
5-hidroksipentanska k.
(-hidroksivalerijanska k.)
ili
Cl
benzoil-hlorid
HO
fenilmetanol
(benzil-alkohol)
+ CH3OH
H2C
H2C
COOCH3
COOH
(kiseli metil-estar cilibarne k.)
(monometil-sukcinat)
+ 2CH3OH
H2C
H2C
COOCH3
COOCH3
(metil-estar cilibarne k.)
(dimetil-sukcinat)
3.5. Reakcijom soli k.k. i halogen-alkana
O
fenilmetil-benzoat
(benzil-benzoat)
RCOOR' + HCl
RCOOAr
fenilmetanol
(benzil-alkohol)
anhidrid
butan-dikiseline
(anhidrid cilibarne k.)
ArOH
(-valerolakton)
ili
HO
+ H2O
COOH
3.3. Reakcijom alkanoil-hlorida i alkohola (ili
fenola)
RCCl + R'OH
ArOH
oksa-2-cikloheksanon
ili
RCOOAr
anhidrid
benzenkarboksilne k.
RCOOR' + RCOOH
(-butirolakton)
ili
O + H2O
oksa-2-ciklopentanon
(-hidroksibuterna k.)
RCOCR + R'OH
C OH
H2
4-hidroksibutanska k.
3.4. Reakcijom anhidrida k.k. i alkohola (ili
fenola)
O O
O
2
46
RCO
O
fenilmetil-benzoat
(benzil-benzoat)
-+
Na + R'X
RCOOR' + Na+ X
1o
O
O
-+
Na
natrijum-etanoat
(natrijum-acetat)
Cl
O
hlorfenilmetan
(benzil-hlorid)
fenilmetil-etanoat
(benzil-acetat)
47
3.6. Reakcijom estra k.k. i alkohola ili fenola
(transesterifikacija)
O
+
H ili OH
RCOR' + R"OH
etil-etanoat
(etil-acetat)
ArOH
RCOOAr
metil-etanoat
(metil-acetat)
etanol
C
1o
O
NH2
C
2o
O
NHR'
C
3o
NR'2
cikloheksankarboksamid
O
NH2
benzenkarboksamid
(benzamid)
4. Amidi k.k.
NH2
N-etilpropanamid
(N-etilpropionamid)
CH3COOCH3 + CH3CH2OH
metanol
O
NH
etanamid
(acetamid)
RCOOR" + R'OH
ili
CH3COOCH2CH3 + CH3OH
O
O
NH2
ili
+
H ili OH
48
CH3
CH3
CH3
NH
6
4
5
aza-2-cikloheksanon
(-valerolaktam)
2,N,N-trimetilbenzenkarboksamid
(2,N,N-trimetilbenzamid)
Dobijanje amida k.k.
4.1. Reakcijom termike dekompozicije
amonijum-soli k.k.
R, R' = alkil- ili aril-grupa
Imenuju se kao ALKANAMIDI.
Kod uobiajenih imena, zavretak SKA
KISELINA zamenjuje se sufiksom AMID.
U ciklinim sistemima zavretak KARBOKSILNA
KISELINA zamenjen je sufiksom KARBOKSAMID.
Supstituenti na azotu oznaavaju se prefiksom Nili N,N- u zavisnosti od broja supstituenata.
Uobiajeno (trivijalno) ime ciklinih amida je
LAKTAM, a po IUPACu su to AZA-2CIKLOALKANONI.
2
3
O
RCOOH + NH3
RCOO + NH4
amonijum-so k.k.
amonijum-alkanoat
RCNH2 + H2O
1o
amid
Prvo se formira amonijum-so koja se nalazi u
ravnotei sa k.k. i NH3.
Na povienoj T termika disocijacija amonijum-soli
postaje znaajna, pa e u ravnotei biti prisutni i
znatne koliine amonijaka i k.k.
Dolazi do sporije, ali termodinamiki favorizovanije
reakcije amina i kiseline.
Iz molekula k.k. i NH3 (nukleofil) adiciono
eliminacionom reakcijom nastaje amid.
Analogno reaguju 1 i 2 amini (alifatini i
aromatini) nastaju 2, odnosno, 3 amidi!
49
NH2
HN
+
CH3CH2CNCH2CH3 + CH3CH2NH2 Cl
CH3CH2CCl + 2CH3CH2NCH3
CH3
propanoil-hlorid
(propionil-hlorid)
CH3COOH +
- +
CH3COO NH3
50
N-metiletanamin
N-etil-N-metilpropanamid
(N-etil-N-metilpropionamid)
+ H2O
(anilinijum-acetat)
2o amid
N-feniletanamid
(N-fenilacetamid)
(acetanilid)
4.2. Reakcijom alkanoil-hlorida i amonijaka, 1 i
2 amina
O
+ 2NH3
NH2
+ RCOO
- +
NH4
1o amid
Analogno reaguju 1 i 2 amini (alifatini i
aromatini) nastaju 2, odnosno, 3 amidi!
+
+ NH4 Cl
NH2
O
R
etilmetilamonijum-hlorid
4.3. Reakcijom anhidrida k.k. i amonijaka, 1 i 2
amina
O
2NH3
CH3
CH3
(etilmetilamin)
1o amid
O
2R'NH2
Cl
2o amid
+ 2HN(CH3)2
anhidrid
benzenkarboksilne k.
2R'2NH
+
NHR' + R'NH3 Cl
N-metilmetanamin
(dimetilamin)
N(CH3)2
N,N-dimetilbezenkarboksamid
(N,N-dimetilbenzamid)
- +
COO NH2(CH3)2
+
+ R'2NH2 Cl
NR'2
3o amid
NH2
O
Cl
NH3 Cl
N
H
dimetilamonijum-benzoat
O
benzoil-hlorid
benzenamin
(anilin)
N-fenilbenzenkarboksamid
(N-fenilbenzamid)
(anilinijum-hlorid)
+ 2NH3
anhidrid
butan-dikiseline
(anhidrid cilibarne k.)
O
+
NH2
H , H2O
- +
O NH4
NH2
OH
O
poluamid butan-dikiseline
(poluamid cilibarne kiselina)
(sukcinaminska k.)
51
O + 2NH3
CONH2
CONH2
+
H , H2O
- +
COO NH4
COOH
52
4.5. Intramolekulska dehidratacija - i -amino k.
sinteza ciklinih amida (laktama)
1
poluamid pentan-dikiseline
(poluamid glutarne k.)
anhidrid
pentan-dikiseline
(anhidrid glutarne k.)
COOH
NH2
4
5
O
R
OR'
+ NH3
2
3
+ R'OH
NH2
1o amid
+ H2NCH3
metil-estar
cikloheksankarboksilne k.
O
1
COOH
NH2
NHCH3
+ CH3OH
+ HN(CH3)2
etil-benzoat
CON(CH3)2
+ CH3CH2OH
N,N-dimetilbenzenkarboksamid
(N,N-dimetilbenzamid)
4
5
+ H2O
aza-2-cikloheksanon
(-valerolaktam)
O
NH2
- +
H
O NH4
2O
O + 2NH3
COOCH2CH3
NH
4.6. Reakcija anhidrida dikarboksilnih k. i
amonijaka, 1 amina sinteza imida (azotovi
analozi ciklinih anhidrida)
O
N-metilcikloheksankarboksamid
5-aminopentanska k.
(-aminovalerijanska k.)
O
OCH3
aza-2-ciklopentanon
(-butirolaktam)
Analogno reaguju 1 i 2 amini (alifatini i
aromatini) nastaju 2, odnosno, 3 amidi!
O
+ H2O
NH
4-aminobutanska k.
(-aminobuterna k.)
4.4. Reakcijom estara k.k. i amonijaka, 1 i 2
amina
- NH3
anhidrid
butan-dikiseline
O
(anhidrid glutarne k.)
anhidrid
pentan-dikiseline
O
aza-2,5-ciklopentandion
(butanimid)
(sukcinimid)
(anhidrid cilibarne k.)
O + 2NH3
NH
CONH2
- +
COO NH4 - H2O
- NH3
NH
O
aza-2,6-cikloheksandion
(pentanimid)
53
4.7. Reakcija dikarboksilnih k. i amonijaka, 1
amina sinteza imida (azotovi analozi ciklinih
anhidrida)
+ 2NH3
COOH
CONH2
- H2O
NH2
OH
- H2O
- NH3
butan-dikiselina
(cilibarna k.)
poluamid butan-dikiseline
(poluamid cilibarne kiselina)
(sukcinaminska k.)
O
2
COOH
COOH
+ 2NH3
pentan-dikiselina
NH
- 2H2O
-NH3
4
5
aza-2,6-cikloheksandion
O
COOH
+ 2NH3
COOH
- 2H2O
-NH3
1,2-benzemdikarboksilna k.
(ftalna k.)
NH
NH
C N
O
aza-2,5-ciklopentandion
(butanimid)
(sukcinimid)
Smatraju se derivatima k.k. jer:
hidrolizom daju k.k.
lako se transformiu u druge derivate k.k.
nitrilni Catom je istog oksidacionog stanja
kao i karboksilni C.
Imenuju se kao ALKANONITRILI.
Uobiajena (trivijalna) imena izvode se obino
zamenom nastavka SKA KISELINA sufiksom
NITRIL.
Cijanocikloalkani se imenuju kao
CIKLOALKANKARBONITRILI.
Kao supstituent, CN se zove CIJANO.
CH3
1,2-benzendikarboksimid
(ftalimid)
Analogno reaguju 1 amini.
R C N
NH3 +
- +
COO NH4
5. Nitrili posebna klasa derivata k.k.
Ar
O
COOH
54
H3C C N
CH3CHCH2CN
etanonitril
(acetonitril)
3-metilbutanonitril
(3-metilbutironitril)
(metil-cijanid)
(2-metilpropil-cijanid)
ciklopentankarbonitril
(ciklopentil-cijanid)
N
butanodinitril
(sukcinonitril)
CN
benzenkarbonitril
(benzonitril)
(fenil-cijanid)
55
Dobijanje nitrila
5.1. Alkanonitrili (alkil-cijanidi) iz halogenalkana
reakcijom nukleofilne supstitucije halogena
cijanidnim jonom
R CN + K+ X
R X + K+ CN
1o
(3o
56
Dobijanje dikarboksilnih kiselina
Analogno dobijanju monokarboksilnih kiselina
samo to se odgovarajue reakcije vre na dva
mesta u molekulu.
Npr. oksidacijom diola, hidrolizom nitrila,
karboksilovanjem Grignardovih reagenasa itd.
eliminacija!!!)
KMnO4/H2SO4
HOCH2CH2OH
5.2. Aromatini nitrili (aril-cijanidi) iz
diazonijumovih soli i CuCN (Sandmeyerova
reakcija)
+
Ar
N N
Cl
CuCN
CN
P2O5,
NH2
- H2O
Ar
Br2
BrCH2
CCl4
R CN
butan-dikiselina
ili
Cl(CH2)4Cl
CN
1,4-dihlorbutan
NH2
NH2
benzenkarboksamid
(benzamid)
1) LiAlH4, aps. etar
+
2) H , H2O
2 KCN
NC(CH2)4CN
heksandinitril
1) Mg, aps. etar
2) CO2
+
3) H , H2O
P2O5,
2 KCN
- H2O
CN
CH2CH2
CN
butanodinitril
1,2-dibrometan
HOOC(CH2)2COOH
Ar
CH2Br
+
H , H2O
butan-dikiselina
ili
H2C CH2
HOOCCH2CH2COOH
5.3. Dehidratacijom 1 amida
O
etan-dikiselina
(oksalna k.)
1,2-etandiol
(etilen-glikol)
eten
Ar
HOOC COOH
C N
benzenkarbonitril
(benzonitril)
HOCH2(CH2)2CH2OH
SOCl2
1,4-butandiol
+
H , H2O
HOOC(CH2)4COOH
heksan-dikiselina
57
Ponaanje dikarboksilnih kiselina pri zagrevanju
1. Etan- i propan-dikiselina se dekarboksiluju
HOOC COOH
CH2
HCOOH + CO2
COOH
CH3COOH + CO2
etanska k.
(sircetna k.)
propan-dikiselina
(malonska k.)
HO
C
H2
HO
CO2 +
HO C CH3
C CH2
HO
enol-oblik
Dekarboksilacija je veoma olakana mogucnoscu obrazovanja
6-clanog ciklicnog prelaznog stanja
(karbonilni O jedne -COOH grupe se ponasa
kao akceptor protona iz -OH grupe druge -COOH grupe)
COOH
- H2O
butan-dikiselina
(cilibarna k.)
COOH
COOH
(anhidrid
cilibarne k.)
pentan-dikiselina
(glutarna k.)
COOH
heksan-dikiselina
(adipinska k.)
COOH
HOOC
heptan-dikiselina
Ba(OH)2;
- H2O
- CO2
Ba(OH)2;
- H 2O
- CO2
O
ciklopentanon
O
cikloheksanon
N H . . . . . . :O
.. C
R
(anhidrid
glutarne k.)
3. Heksan- i heptan-dikiselina zagrevanjem daju
cikline ketone (dekarboksilacija + dehidratacija)
HOOC
. . . . . .: O C
..
- H2O
120 o
Derivati k.k. su POLARNA jedinjenja prisustvo
polarizovane karbonilne grupe!
Hloridi, anhidridi i estri imaju Tklj bliske Tklj aldehida
i ketona sline molekulske mase.
Amidi imaju vie Tklj zbog mogunosti stvaranja
intermolekulskih vodoninih veza:
2. Butan- i pentan-dikiselina zagrevanjem daju
cikline anhidride (dehidratacija)
COOH
+
C
O
trigonalna hibridizacija
Lako dekarboksilovanje malonske kiseline:
....H
.. O. : O:
STRUKTURA I FIZIKE OSOBINE DERIVATA
K.K.
metanska k.
(mravlja k.)
etan-dikiselina
(oksalna k.)
HOOC
58
Jedinjenje
Tklj (C)
R
N H . ... ..
H
O O
CH3CCl
CH3COCCH3
CH3CNH2
51
140
221
Granica rastvorljivosti u vodi je 3 do 5 Catoma za
estre i 3 do 6 Catoma za amide.
Derivati k.k. su rastvorni u uobiajenim organskim
rastvaraima.
Isparljivi estri imaju prijatan, karakteristian miris
hloridi imaju otar, iritirajui miris.
59
60
HEMIJSKE OSOBINE DERIVATA K.K.
NUKLEOFILNA ACILNA SUPSTITUCIJA
Redukcija derivata k.k. sa LiAlH4
Mehanizam adicijeeliminacije
Najvaniji reakcioni put za dobijanje derivata k.k.,
kao i zanjihove meusobne transformacije!
Nukleofil napada karbonilni C (adicija) i nastaje
tetraedarski intermedijer, koji se razlae uz
eliminaciju odlazee grupe.
Ukupna reakcija je supstitucija odlazee grupe
nukleofilom!
Adicionoeliminacione reakcije mogu biti
katalizovane kiselinom ili bazom.
derivat k.k.
Derivat k.k.
O
proizvod
Proizvod redukcije sa
LiAlH4
RCH2OH
RCCl
O O
RCH2OH + HOCH2R
RCOCR
O
RCH2OH + HOR'
RCOR'
O
: O:
RCH2NH2
RCNH2
O
RCNHR'
O
RCNR'2
RCN
RCH2NHR'
RCH2NR'2
RCH2NH2
HOCH2CH2CH2CH2OH
HOCH2CH2CH2CH2CH2OH
1) LiAlH4, aps. etar
2) H +, H2O
C ..
L
derivat k.k.
alkanoil-hlorid
L=
anhidrid
L=
estar
L=
amid
L=
..
:
Cl
..
: O:
..
O
.. C R'
..
O
.. R'
..
NH2
..
NHR'
..
NR'2
61
Mehanizam kiselokatalizovane, adiciono
eliminacione reakcije
Faza 1: protonovanje
:O:
R
..
L
+
.. H
O
+ H+
+
-H
derivat kiseline
(supstrat)
C ..
L
.. H
:O
R
C ..
+ L
Mehanizam baznokatalizovane, adiciono
eliminacione reakcije
Faza 1: deprotonovanje NuH
Nu
.. H
:O
R
+
L
C ..
L
+ : NuH
nukleofil
.. H
:O
..
R C L
Nu
+
+H
+
-H
.. H
:O
+
R C LH
Nu
1 adicija
2 eliminacija
Faza 3: deprotonovanje
+: O
R
+ : LH
Nu
protonovani
proizvod
supstitucije
Nu
+ H+
+ H
naelektrisani
nukleofil
odlazeca
grupa
1 adicija
.. : O:
..
L
Nu
nukleofil
: O:
2 eliminacija
Faza 3: regeneracija katalizatora
.. :L +
Nu
proizvod
supstitucije
Nu
proizvod
supstitucije
H + :B
baza
regenerisani
katalizator
..
:O
+
-H
:O:
derivat kiseline
(supstrat)
+ H
:O
R
: Nu
Faza 2: adicijaeliminacija
C .. + : Nu
R
L
Baza (:B) osigurava maksimalnu koncentraciju
negativno naelektrisanog (deprotonovanog)
nukleofila koji napada karbonilni C.
karbokatjon stabilizovan rezonancijom
(aktivirana karbonilna grupa za napad nukleofila)
.. H
:O
.. - H+
R C L
+ H+
+
Nu H
H + :B
baza
nenaelektrisani katalizator
nukleofil
Faza 2: adicijaeliminacija
+
.. H
O
62
.. + :L
odlazeca
grupa
63
Relativna reaktivnost derivata k.k. u reakcijama
nukleofilne supstitucije adiciono-eliminacionim
mehanizmom
U reakciji nukleofilne supstitucije sa vodom
(hidroliza):
: O:
najreaktivniji
..
R C Cl
.. :
+ H 2O
: O:
..
R C O
.. C R'
20
+ H 2O
: O:
..
R C O
.. R'
..
R C NR'2
+ H2O
20 oC
sporo
+
H ili OH ;
+ H 2O
: O:
najmanje
reaktivan
RCOOH
brzo
: O:
vrlo sporo
+
H ili OH ;
izuzetno sporo
RCOOH
+ R'COOH
RCOOH
RCOOH
+ R'OH
+ HNR'2
..
R C Cl
.. :
najreaktivniji
: O:
R
C ..
L
derivat k.k.
: O:
..
R C O
.. C R'
: O:
>
: O:
: O:
>
..
R C O
.. R'
>
..
R C NH2
najmanje
reaktivan
Ovakav redosled relativne reaktvnosti
..
direktno zavisi od strukture
tj.:
L
koliko je dobra odlazea grupa,
kakav elektronski uticaj vri na
susednu karbonilnu grupu.
<
hloridni
jon
+ HCl
Vano: Redosled relativne rektivnosti derivata
k.k. je dosledan:
: O:
to je
slabija baza, bolja je odlazea
grupa, odnosno, bolje e se odvojiti od molekula
derivat k.k. je reaktivniji.
U sledeem nizu raste baznost odlazee grupe:
Cl
oC
64
.. :L
O
OCR
<
karboksilatni
jon
OR
<
alkoksidni
jon
NH2
amidni
jon
to je karbonilni Catom u strukturi derivata k.k.
elektrofilniji (vie +), derivat je reaktivniji!!!
..
L
U strukturi
za karbonilni C-atom su vezani
heteroatomi: N, O i Cl, koji se razlikuju po relativnoj
elektronegativnosti i veliini (koef. el. negativnosti
respektivno: 3,0; 3,4; 3,2).
..
L
Ukupan elektronski uticaj strukture
na
susednu karbonilnu grupu je odreen dejstvom
njenog:
A. induktivnog (I) i
B. rezonancionog (+R) efekta.
Kao rezultat sveukupnog elektronskog efekta L grupe,
elektrofilnost Catoma karbonilne grupe opada u nizu:
: O:
..
:
R C Cl
..
najpozitivniji
: O:
>
: O:
..
R C O
.. C R'
: O:
>
..
R C O
.. R'
: O:
>
..
R C NH2
najmanje
pozitivan
65
A. Induktivni efekat
to je "I" efekat privlaenja elektrona du veze
L grupe vei, to e karbonilni Catom biti vie +
(elektrofilniji).
Intenzitet I efekta L grupe opada u nizu:
: O:
R C
: O:
..
Cl
.. : > R C
: O:
..
O
.. C R'
: O:
>
R C
..
NH2
najmanje
pozitivan
B. Rezonancioni efekat
Kao i u sluaju k.k. i kod njihovih derivata slob el.
par supstituenta moe biti delokalizovan na
karbonilni Oatom:
C ..
L
(I)
.. : O:
.. : O:
:O :
R
C ..
+ L
(II)
Amidi: L = NH2
dipolarna rezonanciona struktura (III) je
najzastupljenija (N je najmanje
elektronegativan u nizu: O, Cl, N).
: O:
C ..
NH2
Estri: L = OR'
dipolarna rezonanciona struktura (III) je
C ..
neto manje zastupljena (O je
R
OR'
..
elektronegativniji od N).
Ipak je "+R" efekat OR' grupe znaajan.
: O:
: O:
..
O
.. R' > R C
najpozitivniji
66
Anhidridi: L = OCOR'
reaktivniji su od estara jer slob. el. parove
C .. C
R
R' sredinjeg Oatoma dele 2 karbonilne
O
..
grupe, umanjujui tako stabilizaciju
molekula rezonancijom.
: O:
: O:
Hloridi: L = Cl
Najreaktivniji zbog:
C ..
velike rel. el. negativnosti Cl,
:
R
Cl
..
slabog +R efekata Cl (slabo
preklapanje velike 3porbitale Cl sa 2porbitalom
karbonilnog C).
: O:
+
L
(III)
rezonancija u molekulu derivata k.k.
Mogunost rezonancije dovodi do smanjene
elektrofilnosti karbonilnog Catoma!
to je "+R" efekat odavanja elektrona du veze
L grupe vei, dipolarna rezonanciona struktura (III)
e biti vie zastupljena, odnosno, molekul derivata
kiseline e biti stabilniji (manje reaktivan).
Reaktivnost aroil-hlorida je znatno smanjena u
odnosu na alkanoil-hloride.
.. :O:
.. :O:
:O:
.. :O:
+
Cl
Cl
Cl
+
+R efekat arom. prstena smanjuje elektrofilnost karbonilnog C-atoma!!!
Cl
+
67
68
REAKCIJE ADICIJEELIMINACIJE DERIVATA
K.K. SA NUKLEOFILIMA:
sa vodom hidroliza
sa alkoholom alkoholiza
sa amonijakom amonoliza
sa aminima (1 i 2) aminoliza.
1.2. Alkoholiza
1. Alkanoil-halogenidi
Veoma su reaktivni nije potreban katalizator.
1.1. Hidroliza
Veoma burno reaguju sa vodom hidrolizuju ak i
pod uticajem vlage iz vazduha.
Obino se dodaju baze, kao to su hidroksidi
alkalnih metala, piridin ili amini, da neutraliu
sporedni proizvod, HCl.
C ..
Cl
.. :
RCCl + R'OH
k.k.
.. : O:
nukleofil
..
Cl
.. :
:O :
2
: OH
+ 2
.. .. H + : Cl
.. :
+O
odlazeca
grupa
H
+
-H
2 eliminacija
CH3CH2CCl + H2O
propanoil-hlorid
etanol-hlorid
(acetil-hlorid)
CH3CH2COH + HCl
N(CH2CH3)3
1-propanol
HCl
+
CH3COCH2CH2CH3 + HN(CH2CH3)3 Cl
trietilamonijum-hlorid
propil-etanoat
(propil-acetat)
U sluaju aroil-hlorida reakciju alkoholize je
mogue izvoditi u vodenoj sredini u prisustvu
hidroksida alkalnih metala (baza koja neutralie
HCl) s obzirom na njihovu znatno smanjenu
reaktivnost u poreenju sa alkanoil-hloridima.
benzoil-hlorid
..
O
..
O
propanska k.
CH3CCl + CH3CH2CH2OH
Cl
k.k.
RCOR' + HCl
estar
: O:
1 adicija
alkanoil-hlorid
RCOH + HCl
RCCl + H2O
..
HOH
..
alkanoil-hlorid
:O :
Sasvim je analogna reakciji hidrolize, i dobar je
nain za dobijanje estara.
+ CH3OH
metanol
NaOH/H2O
O
OCH3
metil-benzoat
+ + Na Cl
69
1.3. Amonoliza i aminoliza
O
CCl
CNH2
+ HCl
+ NH3 (viak)
benzoil-hlorid
benzenkarboksamid
(benzamid)
NH3
+
NH4 Cl
Analogno reaguju 1 i 2 amini.
Nastali HCl se neutralie vikom amonijaka ili
amina.
70
2. Anhidridi
Reakcije anhidrida k.k. sa nukleofilima su (iako
manje burne) sasvim analogne reakcijama alkanoilhlorida.
Umesto hloridnog jona (Cl) odlazea grupa je
karboksilatni jon (RCOO).
Sa nukleofilima reaguju bez prisustva katalizatora.
Praktina primena: kako su manje reaktivni od
alkanoil-hlorida, anhidridi se radije koriste kao
polazna jedinjenja za dobijanje mnogih derivata k.k.
2.1. Hidroliza
O
O O
RCOH + HOCR
RCOCR + H2O
RC
..
O
..
: O:
CR
..
HOH
..
.. : O:
nukleofil
k.k.
k.k.
anhidrid k.k.
:O:
..
O
..
:O:
:O :
:O :
- ..
C .. H + :OCR
..
R
+O
odlazeca
CR
: OH2
+
grupa
H
+
-H
: O:
1 adicija
2 eliminacija
..
O
..
k.k.
O O
CH3COCCH3 + H2O
anhidrid
sircetne k.
CH3COH + HOCCH3
sircetna k.
: O:
..
HOCR
..
k.k.
71
2.2. Alkoholiza
2.3. Amonoliza i aminoliza
O O
RCOCR + R'OH
RC
..
O
..
: O:
CR
..
HOR'
..
.. : O:
..
O
..
R'
O
..
+ H
nukleofil
:O :
k.k.
estar
:O :
:O :
- ..
C .. H + :OCR
..
R
+O
odlazeca
CR
R'
+
-H
2 eliminacija
O
anhidrid
propanske k.
..
O
..
R'
metil-propanoat
CNH2
COH
+
HO
- +
CO NH4
NH3
amonijum-benzoat
k.k.
O
OCH3
: O:
..
HOCR
..
O
+ CH3OH
anhidrid benzoeve k.
benzenkarboksamid
(benzamid)
estar
+ NH3 (viak)
grupa
: O:
1 adicija
RCOR' + HOCR
anhidrid k.k.
:O:
72
Analogno reaguju 1 i 2 amini.
Nastala ROOH se neutralie vikom amonijaka ili
amina.
propanska k.
Osim u sluaju hidrolize, sporedni proizvod,
karboksilna kiselina, obino je nepoeljna i uklanja
se obradom reakcione smee razblaenim
alkalijama.
Ciklini anhidridi (anhidridi dikarboksilnih k.)
Stupaju u sline reakcije adicijeeliminacije, pri
emu se otvara prsten!
O
O
O
+ H2O
anhidrid
butan-dikiseline
(anhidrid cilibarne k.)
H2C
H2C
COOH
COOH
butan-dikiselina
(cilibarna k.)
(sukcinska k.)
Reakcije sa alkoholima (alkoholiza), amonijakom
(amonoliza) i 1 aminima (aminoliza) su pominjane
kod dobijanja estara i amida.
73
3. Estri
U reakcijama adicijeeliminacije sa nukleofilima su
manje reaktivni od hlorida i anhidrida k.k.
Najee je nuno prisustvo katalizatora.
74
Kao baza se esto koristi sam hidroksilni jon!
:O:
RC
..
+
OR'
..
kalijum-butanoat
.. : O:
nukleofil
katalizator
O
RCOR' + H2O
estar k.k.
RCOR' + H2O
estar k.k.
alkohol
slab
nukleofil
..
O
..
alkoksidni jon
O
-
RCO + HOR'
so k.k.
: O:
2 eliminacija
prevodjenje k.k. u njenu so
3 pod uticajem bazne cestice, alkoksidnog jona
.. O
.. :
..
HOR'
..
alkohol
karboksilatni jon
Poslednja faza je nepovratna karboksilatni jon
(RCOO) je veoma stabilna estica (stabilizovana
rezonancijom)!!!
Molekul alkohola ne moe napasti karboksilatni
jon!!!
Upravo iz tog razloga baznokatalizovana
esterifikacija nije mogua!!!3
alkohol
.. : OH
+ B
..
- ..
:OR'
..
odlazeca
grupa
k.k.
1 adicija
Uloga baze (B) je da transformie slab nukleofil,
vodu, u negativno naelektrisani i veoma nukleofilni
hidroksilni jon.
..
OH
..
: OH
..
RCOH + HOR'
k.k.
B:
bazna-kataliza
:O :
..
OR'
..
Povratna reakcija!
Mehanizam ove reakcije je suprotan rakciji
esterifikacije nukleofil je voda, a eliminie se
alkohol!!!
3.1.2. Baznokatalizovana
Reakcija saponifikacije!
baza
katalzator
.. : OH
..
+ CH3OH
O- K +
metil-butanoat
kisela-kataliza
KOH/H2O
OCH3
3.1. Hidroliza
3.1.1. Kiselokatalizovana
B: +
bazno-katalizovana esterifikacija nije moguca!!!
B: +
..
OR'
..
baza
katalzator
slab
nukleofil
C ..
R
O
..
jak
nukleofil
k.k.
:OR'
alkoksidni
jon
nukleofil
+ B
jak
nukleofil
: O:
:O:
.. :OR'
..
.. - +
O
.. :
karboksilatni anjon
..
HOR'
..
alkohol
75
Zato se baznokatalizovana hidroliza estra
zove SAPONIFIKACIJA?
Kada se masti ili ulja (trigliceridi estri viih
masnih kiselina i glicerola) hidrolizuju u baznoj
sredini u prisustvu NaOH ili KOH, dobija se glicerol i
sapuni (smea Na ili K soli masnih kiselina sa 12
20 Catoma):
O
CH2
O CR'
O
CH
O CR'' + 3NaOH
O
CH2
O CR'''
triglicerid
(mast ili ulje)
76
3.2. Alkoholiza
Reakcija transesterifikacije direktna
transformacija jednog estra u drugi, bez nastajanja
slobodne k.k.
Reakcija je katalizovana kiselinom ili bazom!
O
R'CO- + Na
O
CH OH +
R''CO- + Na
CH2 OH
O
glicerol
R'''CO- +Na
sapuni
RCOR' + R''OH
RCOR'' + HOR'
alkohol
alkohol
estar
O
CH2 OH
+
H ili OR''
estar
Ravnotena reakcija da bi se ravnotea pomerila
u "desno" obino se koristi veliki viak alkohola
(R"OH).
H2SO4
O
OCH2CH3
etil-butanoat
+ CH3OH
metanol
NaOCH3
O
OCH3
metil-butanoat
+ CH3CH2OH
etanol
Mehanizmi transesterifikacije katalizovani
kiselinama ili bazama analogni su mehanizmima
hidroliza u odgovarajue k.k.:
kiselakataliza zapoinje protonovanjem
karbonilnog O estra nakon ega sledi nukleofilni
napad molekula alkohola na karbonilni C
baznakataliza zapoinje deprotonovanjem
alkohola, a nastali alkoksid (OR"), nukleofil, se
adira na karbonilnu grupu estra.
77
3.3. Amonoliza i aminoliza
U reakciji nije potreban katalizator, ali je reakcionu
smeu neophodno zagrevati!
O
COCH2CH3
+ H2NCH3
CNHCH3
+ CH3CH2OH
N-metilbenzenkarboksamid
(N-metilbenzamid)
Analogno reaguju amonijak i 2 amini.
78
4. Amidi
Najmanje reaktivni derivati k.k., delimino i zbog
toga to su jako stabilizovani delokalizacijom slob.
el. para atoma azota.
Posledica toga je da adicionoeliminacione
reakcije u koje stupaju, zahtevaju otre reakcione
uslove.
4.1. Hidroliza
Do hidrolize dolazi samo uz produeno zagrevanje
pod jako kiselim ili baznim uslovima.
4.1.1. Kiselokatalizovana
Povratna reakcija!
kisela-kataliza
O
H
RCNH2 + H2O
amid k.k.
O
NH2
propanamid
+ H2O
H2SO4
O
+
RCOH + NH4
k.k.
amonijum-so
O
OH
propanska k.
+
2+ (NH4)2 SO4
79
Mehanizam bazno-katalizovane hidrolize amida
Mehanizam kiselo-katalizovane hidrolize amida
+
.. H
O
:O:
C
R
..
:OH
R
..
NH2
+
-H
+:O
R
C
: OH
..
H
H
..
NH3
C .. +
NH2
R
..
:OH
+
..
-H
NH2
+H
O
..
H +
+ H+
RC
nukleofil
+
C NH3
+
NH4
amonijum-so
k.k.
O
OH
amid k.k.
N-metilpropanamid
: OH
..
..
O
..
odlazeca
grupa
k.k.
3
: O:
R
.. O
.. :
- ..
:NH2
amidni jon
..
NH3
karboksilatni anjon
Obradom reakcione smee sa razblaenom
mineralnom kiselinom, dobija se k.k.
Cijanidna grupa je polarizovana na Catomu se
- pojavljuje delimino "+" ara tako da
+
R C N
podlee napadu nukleofila!
bazna-kataliza
+ H2O
:O :
Nitrili posebna klasa derivata k.k.
4.1.2. Baznokatalizovana
Nepovratna reakcija!
NHCH3
2 eliminacija
prevodjenje k.k. u njenu so
3 pod uticajem bazne cestice, amidnog jona
2 eliminacija
RCNH2 + H2O
..
NH2
1 adicija
+
OH
.. : O:
:OH
..
..
- ..
NH2 + : OH
..
nukleofil
katalizator
: O:
grupa
1 adicija
..
HOH
..
+
+ H+
OH odlazeca
:O:
..
:OH
+H
..
NH2
+
-H
- H+
80
OH
O
-
RCO + HNH2
so k.k.
O
O
so propanske k.
+ CH3NH2
metilamin
+
H , H2O
O
OH
propanska k.
+
+ CH3NH3
metilamonijum-so
1. Hidroliza nitrila
Veoma otri reakcioni uslovi neophodno
prisustvo koncentrovane kiseline ili baze uz
zagrevanje.
Mehanizmi ovih reakcija vre se preko
intermedijarnog amida i ukljuuje faze adicije
eliminacije!
81
1.1. Kiselokatalizovana
Povratan proces!
1.2. Baznokatalizovana
Nepovratan proces!
kisela-kataliza
H
RCN + H2O
+
RCOH + NH4
k.k.
H2SO4
N + H2O
C(CH2)4C
heksanodinitril
(adiponitril)
bazna-kataliza
nitril
82
amonijum-so
+
2HOOC(CH2)4COOH + (NH4)2 SO4
heksan-dikiselina
(adipinska k.)
N:
..
NH
R
+
-H
+ H
..
+ H+
O
..
NH2
C
..
O
..
N H
..
NH
- H+
..
+ HOH
..
N:
..
NH2
NH2
+ H+
..
OH
..
+
-H
H2O
- ..
+ : OH
..
..
OH
..
..
OH
+
RCOOH + NH4
k.k.
amid
Poetno protonovanje azota cijanidne grupe je
praeno nukleofilnim napadom molekula vode.
Deprotonovanjem nastaje neutralni intermedijer,
imino kiselina, koji tautomerizuje u amid.
Amid dalje hidrolizuje kao to je ranije opisano.
R
- H+
NH3
amonijak
.. O
..:
amidatni jon
..
OH
..
..
O
..
..
NH
..
OH
..
anjon imino kiseline
- ..
: NH
..
NH
- H2O
so k.k.
.. N:
R
imino kiselina
(tautome amida)
R C
..
R C N H
+
RCOO
Mehanizam bazno-katalizovane hidrolize nitrila
nukleofil
katalizator
nitril
Mehanizam kiselo-katalizovane hidrolize nitrila
+ H+
OH
RCN + H2O
..
O
..
- ..
: OH
..
- H 2O
+ H 2O
imino kiselina
(tautomer amida)
..
NH2
..
OH
..
..
O
..
- ..
: OH
..
RCOO
+ NH3
so k.k.
amid
+ H+
Direktan napad hidroksilnog jona daje anjon imino
kiseline (amidnog tautomera), koji se protonuje na
azotu dajui imino kiselinu (tautomer amida).
Imino kiselina tautomerizuje u amid koji dalje
hidrolizuje kao to je ranije opisano.
Obradom reakcione smee sa razblaenom
mineralnom kiselinom, dobija se k.k.
83
2. Alkoholiza nitrila
Kiselokatalizovana reakcija.
kisela-kataliza
H
RCN + R'OH
nitril
N:
..
NH
R
+ H+
R C
+
-H
N H
84
Reakcija derivata k.k. sa Grignardovim
reagensima
1. Alkanoil-hloridi
NH
2
RCOR'
iminoestar
..
R C N H
+
..
+ R'OH
..
- R'OH
Cl
- MgXCl
alkanoil-hlorid
R'
R'
iminoestar
R'
3o
alkohol
1 adicija-eliminacija (nukleofilna acilna supstitucija)
..
OR'
..
2 nukleofilna adicija Grignard-ovog reagensa na keton
Hidrolizom iminoestra se dobija estar k.k.
NH
RCOR' + H2O
OH
R'
keton
ne moe se izolovati
1) R'MgX
2) H+ , H O
R'MgX
..
NH
+ H -H
..
+ H+
O
iminoestar
1) aps. etar
2) H+ , H O
O
CH3CH2CCl + 2 H3C MgBr
RCOOR' + NH4
OH
CH3CH2
propanoil-hlorid
C CH3
CH3
2-metil-2-butanol
estar k.k.
3o alkohol
1) aps. etar
2) H+ , H O
O
Cl
+ 2
MgCl
OH
propanoil-hlorid
1,1-difenil-1-propanol
85
: O:
R
+ R''
..
Cl
.. :
MgX
.. : O: +MgX
2
..
:
R C Cl
..
- ClMgX
R''
86
2. Estri
2
alkanoil-hlorid
: O:
R
R''
+ R''
MgX
.. : O: +MgX
C
R''
keton
ne moe se izolovati
R''MgX
OR' - R'OMgX
estar
1) R''MgX
2) H+ , H O
O
R
R''
R''
R''
keton
3o alkohol
ne moe se izolovati
R''
OH
adicija-eliminacija (nukleofilna acilna supstitucija)
2 nukleofilna adicija Grignard-ovog reagensa na keton
OH
R
R''
H+, H2O
R''
3o alkohol
1 +
1) aps. etar
2) H+ , H O
O
COCH2CH3
+ 2 H3C MgBr
3 nukleofilna adicija Grignard-ovog reagensa na keton
O
H COCH2CH3 + 2 H3C MgBr
etil-formijat
C CH3
CH3
etil-benzoat
2 = adicija-eliminacija (nukleofilna acilna supstitucija)
OH
2-fenil-2-propanol
3o alkohol
1) aps. etar
2) H+ , H O
2
OH
H C CH3
CH3
2-propanol
2o alkohol
87
: O:
R
+ R''
..
OR'
..
MgX
.. : O: +MgX
..
R C OR'
..
R''
estar
: O:
R
R''
+ R''
MgX
88
3. Nitrili
2
- R'OMgX
1) R'MgX
2) H+ , H O
- Mg(OH)X
R''
R'
H+, H2O
R''
1) aps. etar
2) H+ , H O
R''
R'
nitril
N: +
MgBr
2-heksanon
butilmagnezijum-bromid
etanonitril
(acetonitril)
imin
+
+ NH4
keton
R''
+
H , H 2O
.. : O: +MgX
keton
ne moe se izolovati
OH
NH
R'
.. - +
N: MgX
MgX
R'
..
NH
H+, H2O
- Mg(OH)X
anjonska imino so
R'
imin
3o alkohol
O
1 +
2 = adicija-eliminacija (nukleofilna acilna supstitucija)
3 nukleofilna adicija Grignard-ovog reagensa na keton
C
keton
Reakcije estara k.k. sa Grignarovim reagensima
sasvim su analogne reakcijama hlorida kao
proizvod nastaje 3 alkohol!
U reakciji nukleofilne acilne supstitucije ( + ), u
fazi eliminacije umesto hloridnog jona (Cl) odlazea
grupa je alkoksidni jon (OR').
+
+ NH4
R'
+
H , H2O
89
Amidi su amfoterna jedinjenja
Mogu da reaguju kao:
slabe baze
slabe kiseline.
Slabe baze
Amidi su mnogo slabije baze od amina!!!
U molekulu amida mogue je protonovanje na 2
mesta na N i na karbonilnom O!
: O:
C + H
N
R
H
(nema stabilizacije
H
rezonancijom)
protonovanje na N
+ H+
+
-H
.. : O:
.. : O:
:O :
C ..
R
NH2
(I)
C ..
R + NH2
+
NH2
(III)
(II)
rezonancija u molekulu amida
+
-H
+ H+
protonovanje na O
+
.. H
O
.. H
:O
C ..
R
NH2
C ..
R + NH2
90
Protonovanje na N
Slobodan el. par sa N uestvuje u rezonanciji sa
"=" vezom karbonilne grupe:
molekul amida je stabilizovan rezonancijom
za razliku od protonovanog amida
kao posledica delokalizacije slob. el. para sa
N na karbonilno O javlja se delimino "+"
naelektrisanje na N
ime je jako smanjena baznost amida!
Protonovanje na O
Protonovanjem na karbonilnom O nastaje katjon
koji je rezonanciono stabilizovan (rezonanciona
stabilizacija "+" are) jae je rezonanciono
stabilizovan od neprotonovanog amida (razdvajanje
naelektrisanja).
Vano: do protonovanja dolazi na
karbonilnom O i to u jako kiselim uslovima!
Slabe kiseline
Vodonici iz amino grupe 1 i 2 amida su slabo
kiseli zbog delimino "+" are na N:
.. : O:
.. H
:O
R
+
NH2
katjon stabilizovan rezonancijom
(delokalizacija "+" are - jace stabilizovan rezonancijom
od neprotonovanog amida)
.. : O:
+
NH
(III)
(III)
1o
2o
+
NR'
91
92
Svoje slabo kisele osobine mogu manifestovati
iskljuivo u jako baznim uslovima:
:O:
R
..
N
H
+ - ..
Na : NH2
natrijum-amid
jaka baza
C ..NH
..
ftalimid
Imidi su kiseli
Vodonik na N u strukturi imida je kiseo zbog
delimino "+" are na N:
..O ..
ftalimid
..O..
:N H
..O..
..O..
..
NH
amidatni jon
rezonanciono stabilizovan
: N:
.. ..O..
imidatni jon
rezonanciono stabilizovan
+
N H
..O..
+ BrCH2CH2CH3
RX mora biti 1o
S obzirom da je delokalizacija slob. el. para sa N
kod imida vea nego kod amida, IMIDI:
praktino nemaju bazni karakter
znatno su jae kiseline od amida
mogu se deprotonovati u znatno blaim baznim
uslovima (vodeni rastvor hidroksida ili karbonata)
nastaje rezonanciono stabilizovan imidatni jon.
.. ..
O
: N CH2CH2CH3
(SN2)
..O..
- KBr
OH /H2O
kalijum-ftalimid
COO
+
N H
delokalizacija slob. el. para sa N
..O..
.. -
..O..
Gabriel-ova sinteza 1o amina:
..O..
..O..
.. -
N:
Imidatni jon moe da reaguje sa jedinjenjima koja
sadre polarizovanu vezi CX (ugljenikhalogen).
: N : K+
..O..
..O..
N:
..O..
..O..
.. ..O..
..O..
..O..
:N
KOH/H2O
:N H
.. : O:
: O:
NH3 + Na
..O..
H2N CH2CH2CH3
+
-
propilamin
..O..
kalijum-ftalimid
.. ..
O
: N : K+
..O..
COO
Gabriel-ova sinteza 2-aminokarboksilnih k.:
-
+ ClCH2COCH2CH3
etil-hloretanoat
(etil-hloracetat)
-halogenestar
: N CH2COOCH2CH3
(SN2)
- KCl
..O..
1) OH /H2O;
+
2) H /H2O
+
H3NCH2COO +
2-aminoetanska k.
(glicin)
COOH
COOH
93
HellVollhardtZelinsky reakcija
Slino aldehidima i ketonima, -Catom alkanskih
(alifatinih) k. moe se halogenovati pomou X2
(Cl2, Br2) u prisustvu kat. koliine elementarnog
(crvenog) fosfora:
R CH COOH + X2
94
Iz ,-nezasiene k. konjugovanom adicijom moe
nastati itav niz sistema.
+
H /H2O
OH
HX
R CH COOH + HX
X
2-halogenkarboksilna k.
(-halogensupstituisana k.)
(-nezasicena k.)
NH3
RCH2CHCOOH
CN
NO2
RCH2CHCOOH
NO2
HCN
1) OH /H2O
2) H+ /H O
2
2-cijanokarboksilna k.
(-cijanokiselina)
1) KOH/ alkohol;
2) H+/H O
2
RCHCH2COOH
O
_
2-nitrokarboksilna k.
(-nitrokiselina)
RCH2CHCOOH
2-hidroksikarboksilna k.
(-hidroksikiselina)
RCH2CHCOO 2-aminokarboksilna k.
(-aminokiselina)
+ NH3
RCH CHCOOH (-nezasicena k.)
3-halogenkarboksilna k.
(-halogenkiselina)
3-aminokarboksilna k.
(-aminokiselina)
3-cijanokarboksilna k.
(-cijanokiselina)
Ovo je zapravo 1,4adicija nukleofilnog reagensa
HB na ,-nezasieni karbonilni sistem:
+
OH
+
H B
1,4-adicija
Cini se da je doslo
do 1,2-adicije NuH
na dvostruku vezu C-C!!!
OH
C
OH
NH3/H2O
RCHCH2COO -
CN
RCH2CHCOOH (S 2)
N
X
RCHCH2COOH
+ NH3
Prevoenje -halogensupstituisane k. u druge
supst. k.:
CN
3-hidroksikarboksilna k.
(-hidroksikiselina)
RCH CHCOOH
Mogu se zameniti svi -Hatomi!
RCHCH2COOH
enol-oblik
izomerizacija
C
H
O
C
OH
95
Dietil-malonat
Malonska kiselina je vaan predstavnik dikiselina.
Znatno vei sintetski znaaj ima njen dietil-estar
dietil-propandioat (dietil-malonat)!
CH3COOH
Cl2
ClCH2COOH
NCCH2COO- Na+
H+, H2O
NaOH/H2O
ClCH2COO
HOOCCH2COOH
CH3CH2OCCHCOCH2CH3
jaca k.
pKa = 13
..
Na+ CH3CH2O
..
: O:
C
..CH
: O:
C
..
OCH
CH3
2
..
+
H , H2O
H2C
OCH2CH3
COCH2CH3
COCH2CH3
O
iminoestar
+ CH3CH2OH
slabija k.
pKa = 15,9
:O :
CH
COCH2CH3
+ ..
+ Na : OCH
.. 2CH3
..
CH3CH2O
..
HN
.. : O:
CH3CH2OH
H2SO4
Na+
Dietil-malonat se u reakciji sa jakim bazama
ponaa kao kiselina:
propan-dikiselina
(malonska k.)
natrijumova so
cijanosircetne k.
H2C
CN
96
..
OCH
.. 2CH3
.. :O:
: O:
..
CH3CH2O
..
CH
..
OCH
.. 2CH3
rezonanciona stabilizacija anjona
dietil-propandioat
alkoholiza
N C CH2
(dietil-malonat)
O
CO
Na+
esterifikacija
U strukturi dietil-malonata Hatomi metilenske
grupe su kiseli:
deluje "I" efekat
H
:
:
:
:
O
2 karbonilne grupe
+ O
CH3CH2O C
C OCH2CH3
C
(destabilizuje
+
+
molekul olakava
H
odlazak H+)
anjon koji nastaje odlaskom H+ je stabilizovan
rezonancijom
97
98
Malonestrarska sinteza
Dietil-malonat se koristi kao prekursor (polazno
jedinjenje) u sintezi alkil- i dialkilsiretnih k.
Postupak se zove malonestarska sinteza!
Zasniva se na:
velikoj kiselosti metilenskih Hatoma u
strukturi dietil-malonata
veoma lakoj dekarboksilaciji malonske
kiseline i supstituisanih malonskih kiselina.
CO2CH2CH3
H C H
CO2CH2CH3
CO2CH2CH3
H C R
alkilovanje
CO2CH2CH3
CO2CH2CH3
- :C R
+
Na
+
Na - OC2H5
C2H5OH
R'
alkilovanje
CO2CH2CH3
CO2CH2CH3
R'
C R
CO2CH2CH3
H
H C COOH
R
Pravila i ogranienja SN2 reakcija vae i za faze
alkilovanja!!!
Osim 1 i 2 halogenalkana mogu se koristiti i
druga jedinjenja koja u molekulu sadre
polarizovanu vezu CX:
H C COOH
CO2CH2CH3
R
(disupstituisana sircetna k.)
H C R
OH /H2O
COO
H C R
C R
CO2CH2CH3
(dietil-dialkilmalonat)
COOH
+
H /H2O
H C R
COO -
COOH
- CO2
COOH
H C R
H
supstituisana malonska k.
(dietil-alkilmalonat)
R'
CH2CR'
-halogenketon
-halogenestar
CO2CH2CH3
CO2CH2CH3
CH2COR'
alkanoil-halogenid
R'
O
RCX
CH3CH2O C C C OCH2CH3
(dietil-alkilmalonat)
(monosupstituisana sircetna k.)
O R' O
(dietil-dialkilmalonat)
CH3CH2O C C C OCH2CH3
CH3CH2O C C C OCH2CH3
C2H5OH
CO2CH2CH3
O H O
O H O
CO2CH2CH3
H C: Na+
+Na OC2H5
OH /H2O
COO R'
C R
COO -
+
H /H2O
COOH
R'
C R
COOH
- CO2
disupstituisana malonska k.
COOH
R'
C R
H
99
Lako dekarboksilovanje malonske kiseline:
....H
.. O.
: O:
HO
C
H2
HO
CO2 +
C CH2
HO
enol-oblik
HO C CH3
100
ZADATAK
Koristei dietil-malonat i ostale reaktive, prikaite
sintezu:
a) 3-fenilpropanske kiseline
Dekarboksilacija je veoma olakana mogucnoscu obrazovanja
6-clanog ciklicnog prelaznog stanja
(karbonilni O jedne -COOH grupe se ponasa
kao akceptor protona iz -OH grupe druge -COOH grupe)
CO2CH2CH3
COOH
H C H
H C CH2
H
CO2CH2CH3
CO2CH2CH3
H C H
CO2CH2CH3
CO2CH2CH3
H C
CH2
CO2CH2CH3
H C: Na+
+
Na - OC2H5
C2H5OH
OH - /H2O
COOH
CH2
COOH
Cl
CO2CH2CH3
CO2CH2CH3
H C
CH2
COO
H C
CH2
COO -
COOH
- CO2
H C CH2
H
3-fenilpropanska k.
+
H /H2O
101
b) 2-etilbutan-dikiseline
COOH
CO2CH2CH3
H C H
HOOC
CH2
C CH2CH3
CO2CH2CH3
CO2CH2CH3
H C H
CO2CH2CH3
CO2CH2CH3
H C CH2CH3
CO2CH2CH3
H C: Na+
+
Na - OC2H5
C2H5OH
CO2CH2CH3
+
Na - OC2H5
C2H5OH
CO2CH2CH3
CO2CH2CH3
- : C CH CH
+
Na
2
3
Br
OH - /H2O
C CH2CH3
COO
-
OOCCH2
CO2CH2CH3
COOH
HOOCCH2
C CH2CH3
COO
+
H /H2O
COOH
C CH2CH3
COOH
CH2CO2CH2CH3
CO2CH2CH3
CO2CH2CH3
CH3CH2O2CCH2
CH3CH2 Br
- CO2
HOOCCH2
C CH2CH3
H
2-etilbutan-dikiselina
O
X
CH2COR'
-halogenestar
Mora biti estar!
Nikako -halogensupstituisana k.
(jaa k. XCH2COOH bi istisnula
slabiju, dietil-malonat, iz njene soli).
You might also like
- Karboksilne KiselineDocument68 pagesKarboksilne KiselineLaura100% (1)
- Aldehidi I KetoniDocument48 pagesAldehidi I Ketoniljdesp100% (1)
- Aldehidi & Ketoni-Grupe TMFDocument41 pagesAldehidi & Ketoni-Grupe TMFZoran PavlovicNo ratings yet
- Karboksilne Kiseline I Derivati Karboksilnih KiselinaDocument24 pagesKarboksilne Kiseline I Derivati Karboksilnih KiselinaPravnikNPNo ratings yet
- Proizvod RastvorljivostiDocument38 pagesProizvod RastvorljivostiFejzaNo ratings yet
- Alkoholi - Organska Hemija - Hemijska JedinjenjaDocument56 pagesAlkoholi - Organska Hemija - Hemijska JedinjenjaMaturski Rad HemijaNo ratings yet
- Elektroliza Vodenih OtopinaDocument1 pageElektroliza Vodenih Otopinaljdesp100% (1)
- Protilitiča Teorija, Kisleina, Baze I SoliDocument36 pagesProtilitiča Teorija, Kisleina, Baze I SoliMiloš RadovanovićNo ratings yet
- HP Rešeni Primeri Za VežbanjeDocument9 pagesHP Rešeni Primeri Za VežbanjeAna PavlovicNo ratings yet
- PuferDocument23 pagesPufermijana9mileticNo ratings yet
- Organska I - Drugi KolokvijumDocument97 pagesOrganska I - Drugi KolokvijumBožana TomićNo ratings yet
- V Vezbe Heterogene Ravnoteze 1417514894563 PDFDocument7 pagesV Vezbe Heterogene Ravnoteze 1417514894563 PDFljdespNo ratings yet
- V Vezbe Heterogene Ravnoteze 1417514894563 PDFDocument7 pagesV Vezbe Heterogene Ravnoteze 1417514894563 PDFljdespNo ratings yet
- V Vezbe Heterogene Ravnoteze 1417514894563 PDFDocument7 pagesV Vezbe Heterogene Ravnoteze 1417514894563 PDFljdespNo ratings yet
- Alifaticni ZadaciDocument11 pagesAlifaticni ZadaciDanijela KitanovićNo ratings yet
- NP Hemija R7Document257 pagesNP Hemija R7backspaceupNo ratings yet
- Halkogeni ElmentiDocument9 pagesHalkogeni ElmentiljdespNo ratings yet
- DERIVATIDocument52 pagesDERIVATIlepton1973No ratings yet
- Karboksilne KiselineDocument4 pagesKarboksilne Kiselineapi-270998884No ratings yet
- UGLJOVODONICIDocument29 pagesUGLJOVODONICIcakivaNo ratings yet
- 18.Predavanje-Karbonske KiselineDocument18 pages18.Predavanje-Karbonske Kiselinemferi92100% (1)
- Hemija-10.vezba 2013 PDFDocument34 pagesHemija-10.vezba 2013 PDFVanroNo ratings yet
- VIII Organska Kiseonicna JedinjenjaDocument4 pagesVIII Organska Kiseonicna JedinjenjaTanjaNo ratings yet
- Матурски из хемијеDocument18 pagesМатурски из хемијеSara JankovićNo ratings yet
- Analitička HemijaDocument118 pagesAnalitička HemijaIvana RadinNo ratings yet
- Granicne-Vrednosti (Primeri Sa Kolokvijuma I Ispita)Document4 pagesGranicne-Vrednosti (Primeri Sa Kolokvijuma I Ispita)Science and Games ExperimentsNo ratings yet
- Organska Jedinjenja Sa AzotomDocument30 pagesOrganska Jedinjenja Sa AzotomЈован Баљак100% (1)
- оцене табелаDocument18 pagesоцене табелаdaniloaksicNo ratings yet
- TJ 12 Metode Oksido-Redukcijskih TitracijaDocument44 pagesTJ 12 Metode Oksido-Redukcijskih TitracijaGorannnNo ratings yet
- 28-11 - I 4-12-2013 Proizvod RastvorljivostiDocument12 pages28-11 - I 4-12-2013 Proizvod Rastvorljivostibilinda_butcherNo ratings yet
- 8.kiseline I BazeDocument14 pages8.kiseline I BazeZoran IvanovićNo ratings yet
- HemijaDocument29 pagesHemijaanon_300656446No ratings yet
- 4 AlkeniDocument36 pages4 AlkeniljdespNo ratings yet
- Opsta Hemija IIDocument71 pagesOpsta Hemija IIpgfrwe100% (1)
- 16 AminiDocument35 pages16 AminiNeda JanićijevićNo ratings yet
- Kemija 4 Razred Gimnazije Sažetak ALDEHIDI, Ketoni, Esteri Karboksilne Kiseline, AmidiDocument1 pageKemija 4 Razred Gimnazije Sažetak ALDEHIDI, Ketoni, Esteri Karboksilne Kiseline, AmidirtdtNo ratings yet
- Ugljeni HidratiDocument11 pagesUgljeni HidratiNikola SvorcanNo ratings yet
- KompleksiDocument27 pagesKompleksiDejan MiticNo ratings yet
- Aromaticni Ugljovodonici - 2010Document47 pagesAromaticni Ugljovodonici - 2010Sofia Valeska Tutunović50% (2)
- Stehiometrijski ZadaciDocument4 pagesStehiometrijski ZadaciRadica Miljkovic100% (1)
- Vezbanje Opsta Rastvori 2Document3 pagesVezbanje Opsta Rastvori 2Lela SNo ratings yet
- Limesi-Granicne VrednostiDocument9 pagesLimesi-Granicne VrednostiMilan MilosavljevicNo ratings yet
- Zadaci Za Vezbanje Azot I FosforDocument2 pagesZadaci Za Vezbanje Azot I FosforKristina FilipovićNo ratings yet
- Organska Jedinjenja SumporaDocument18 pagesOrganska Jedinjenja SumporaТамара ВасићNo ratings yet
- Elektrolitic48dka Disocijacija I PH Vrednost ZadaciDocument1 pageElektrolitic48dka Disocijacija I PH Vrednost ZadaciDragan GligorovNo ratings yet
- 19.Predavanje-Karbonske Kiseline-Nezasicene I DikarbonskeDocument14 pages19.Predavanje-Karbonske Kiseline-Nezasicene I Dikarbonskemferi92No ratings yet
- Test EDocument5 pagesTest EJelena SavicNo ratings yet
- Aromatična Jedinjenja 1Document35 pagesAromatična Jedinjenja 1ArtyomNo ratings yet
- Amini I Nitro JedinjenjaDocument4 pagesAmini I Nitro JedinjenjaRadica MiljkovicNo ratings yet
- Hidroliza Slabih BazaDocument5 pagesHidroliza Slabih BazaIvona SamoopuštenoNo ratings yet
- ETRIDocument1 pageETRIEddie McCleisterNo ratings yet
- HemijaDocument49 pagesHemijaNikola MicicNo ratings yet
- хемијске реакцијеDocument3 pagesхемијске реакцијеMilorad ZelenovicNo ratings yet
- OrganskaI 2kolDocument349 pagesOrganskaI 2kolJelenaNo ratings yet
- Oksidi, Hidridi TEORIJADocument5 pagesOksidi, Hidridi TEORIJAsladjad83No ratings yet
- N Jedinjenja 2-3Document4 pagesN Jedinjenja 2-3Vaso MuharemovicNo ratings yet
- IV Raz 8 KARBOKSILNE KISELINE 2020 +++Document6 pagesIV Raz 8 KARBOKSILNE KISELINE 2020 +++Egov AlteroNo ratings yet
- Karboksilne Kiseline I AlkoholiDocument39 pagesKarboksilne Kiseline I AlkoholiDr Banic BranislavNo ratings yet
- Karbonske Kiselin1Document4 pagesKarbonske Kiselin1AleksaNo ratings yet
- Derivati Karboksilnih KiselinaDocument31 pagesDerivati Karboksilnih Kiselinabotnakvadrat000100% (1)
- Карбоксилне киселинеDocument5 pagesКарбоксилне киселинеMrs. SalvadorNo ratings yet
- 18.karbonilna JedinjenjaDocument44 pages18.karbonilna JedinjenjasanjacaricaNo ratings yet
- 12 - Karboksilne KiselineDocument63 pages12 - Karboksilne KiselineElvir MNo ratings yet
- Karboksilne Kiseline BOBANDocument20 pagesKarboksilne Kiseline BOBANnemanjamitric90-1No ratings yet
- Termin VOLUMETRIJSKE (TITRIMETRIJSKE) METODE ANALIZEDocument29 pagesTermin VOLUMETRIJSKE (TITRIMETRIJSKE) METODE ANALIZEljdespNo ratings yet
- Halogeni ElementiDocument6 pagesHalogeni ElementiljdespNo ratings yet
- IONSKA VEZA NovaDocument11 pagesIONSKA VEZA NovaljdespNo ratings yet
- Spojevi UgljikaDocument3 pagesSpojevi UgljikaljdespNo ratings yet
- 010 FizhemDocument12 pages010 FizhemljdespNo ratings yet
- 8 - Aromaticni UgljovodoniciDocument76 pages8 - Aromaticni UgljovodoniciLawrence WilliamsNo ratings yet
- 5 AlkiniDocument39 pages5 AlkiniljdespNo ratings yet
- Alkil Halogenidii 2015Document33 pagesAlkil Halogenidii 2015ljdespNo ratings yet
- 6-STRUKTURA MOLEKULA - v2015 PDFDocument20 pages6-STRUKTURA MOLEKULA - v2015 PDFljdespNo ratings yet
- 8 - Aromaticni UgljovodoniciDocument76 pages8 - Aromaticni UgljovodoniciLawrence WilliamsNo ratings yet
- V Vezbe Heterogene Ravnoteze 1417514894563Document7 pagesV Vezbe Heterogene Ravnoteze 1417514894563ljdespNo ratings yet
- 4 AlkeniDocument36 pages4 AlkeniljdespNo ratings yet
- 5 AlkiniDocument39 pages5 AlkiniljdespNo ratings yet
- Stereo Izo Meri JaDocument54 pagesStereo Izo Meri JaCharles JohnsonNo ratings yet
- 20 Azotna JedDocument83 pages20 Azotna JedljdespNo ratings yet
- 1.Š GenetikaDocument1 page1.Š GenetikaljdespNo ratings yet