Professional Documents
Culture Documents
Bài giảng - chương 1.2
Bài giảng - chương 1.2
Uploaded by
Đặng Thiên PhướcCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Bài giảng - chương 1.2
Bài giảng - chương 1.2
Uploaded by
Đặng Thiên PhướcCopyright:
Available Formats
induction effect: hiệu ứng cảm ứng là hiện tượng mà 1 lk phân cực mà làm cho cặp e dùng chung
lệch về 1 phía
Sự cảm ứng và liên kết CHT phân cực
(Induction and polar covalent bonds)
( chỉ có khi có liên kết
Độ âm điện ( ): biểu diễn khả năng giữ electron khi nguyên tử tạo thành liên kết.
electronegativity ( hút) được hình thành)
H khi nguyên tử ktạo thành liên kết:
+ H
H C O - khả năng giữ e được đặc trưng bởi
đại lượng NL Ion hóa và Ái Lực e
H hiện tượng Ion âm biến dạng:
1 Ion dương có kích thước nhỏ
có thể xem H H và điện tích lớn làm cho ion âm
là lk ion H C Li H C MgCl đang ở gần nó bị biến dạng và
hay CHT làm cho e từ cacbon từ phân cực
H H hoàn toàn chuyển ra chính giữa
một phần
H H vì Ion dương bé nên hạt nhân nó
| A- B| =
H C Li H C MgCl sẽ gần với vỏ electron hóa trị của
0 - 0.4/0.5: liên kết CHT ko phân cực (apolar) ion âm
H A B
H 0.4/0.5 - 1.7: liên kết CHT phân cực
Li+ Mg2+ nhỏ nên có khả năng cực hóa ion âm A+B- > 1.7: liên kết ion có 1 vài ngoại lệ dù hiệu độ âm điện >1.7 nhưng vẫn k phân li
hoàn toàn trong H2O
chỉ có thể là H k biểu diễn lk ion
ví dụ: HF.( do độ bền liên kết lớn)
Lk Ion H C K C Br Liên kết CHT phân cực ( dù hiệu độ âm điện<0.4)
H C I qui tắc này chỉ mang tính tương đối
K+ lớn nên k có khả năng cực hóa ion âm
Diagram: giản đồ
Bản đồ thế tĩnh điện
Scheme: sơ đồ
Electrostatic Potential Maps
Figure: hình
cho biết mật độ electron cho cả phân tử
bước sóng càng lớn càng âm điện
bước sóng càng bé càng dương điẹn
Reading Bond-Line Structures
H
H H
C
CH3-CH3 C
H H
H
CH3-CH2-CH2-CH3
H2
C CH3
H 3C C Dị tố (heteroatom): những nguyên tố khác C, H
H2
OH
CH3-CH2-NH-CH2-CH2-OH N
H3C H CH3 H3C H CH3 H
C Cl
C
CH3 H 3C
H
spin N thuốc trị mất ngủ, động kinh, lo âu
H N
electron H O
hạt nhân orbit H H
Diazepam
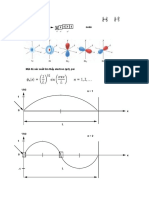
Khi điền electron vào giản đồ năng lượng của nguyên tử hay phân tử, phải tuân theo các nguyên tắc:
1/ Nguyên lý Aufbau/ Klechsckovskii: điền electron vào orbital có năng lượng từ thấp đến cao NL thấp thì bền
2/ Nguyên lý loại trừ Pauli: mỗi orbital chỉ chứa tối đa 2 electron có số spin trái nhau
spin: hạt tự xoay quanh trục của mình electron có cả 2
orbit: hạt di chuyển quanh 1 quĩ đạo
B: C:
2s2 2p1 2s2 2p1 đúng 2s2 2p2 2s2 2p2
Biểu diễn sai
spin trái nhau: tự xoay quanh trụ của mình nhưng ngược chiều nhau
3/ Quy tắc Hund: trên phân lớp chứa các orbital suy biến (degenerate orbitals), electron phải bổ sung vào
toàn bộ các orbital, sau đó mới ghép đôi Lưu ý: khi bổ sung e vào toàn bộ orbitan trước lúc ghép đôi thì
bổ sung spin +1/2 hay -1/2 đều được vì quay qua trái hay phải là
do góc nhìn từ trên xuống hay dưới lên nhưng theo qui ước chung
thì bổ sung spin +1/2 trước, nếu bổ sung +1/2 trước thì phải bổ
sung cho toàn bộ
Thuyết liên kết cộng hóa trị (Valence bond theory)
Liên kết CHT được hình thành nhờ sự dùng chung electron của 2 nguyên tử, là kết quả của sự xen phủ orbital.
electron nằm chính giữa
và nằm ở vùng 2 nguyên
tử xen phủ( mật độ e lớn
nhất là vùng ở giữa 2 hạt nhân)
nằm trên trục nối 2 hạt nhân nguyên tử
Liên kết đơn đầu tiên sau khi được tạo thành nhờ sự xen phủ orbital gọi là liên kết sigma ( ). Liên kết sigma là sự
xen phủ trục (liên kết nằm trên trục nối 2 hạt nhân nguyên tử).
1 electron của p lớp 2s bị kích thích Hiện tượng lai hóa sp3
nên e chuyển lên 1 phân lớp 2p trống
tạo 4 e độc thân H
4 e độc thân đó tạo lk cht với hidro H C H
1 orbitan 2s trộn với 3 orbitan 2p H
để tạo ra 4 rbitan lai hóa sp3
( đó là lí do giải thích vì sao k có sự
khác nhau giữa 4 lk C-H )
Thùy lớn
Thùy
nhỏ
orbitanlai hóa sp3
4 electron có năng lượng bằng nhau cùng nằm trên orbital sp3
Liên kết sigma
(lk lai hóa sp3)
Orbital s nằm gần hạt nhân hơn orbital p H
cho nên nguyên tử có bản chất s (s character) càng lớn
thì sẽ thường có bán kính nhỏ và độ âm điện cao.
electron gần hạt nhân nên e khó bứt ra
vân đạo ban đầu chỉ dựa trên tính toán trên phương trình sóng để đưa
ra quĩ đạo của electron nhưng bây giờ chụp đc vân đạo của nguyên tử hidro
( chỉ chụp đc vân đạo chứ k chụp được electron)
Carbon lai hóa sp3
mang 25% đặc tính s và 75% đặc tính p
You might also like
- 1a.-CHEM1421 Chuong-1 Liên-K T UnlockedDocument19 pages1a.-CHEM1421 Chuong-1 Liên-K T UnlockedDuyên NguyễnNo ratings yet
- Hoa-Dai-Cuong - Nguyen-Son-Bach - Chuong-4-Lien-Ket-Hoa-Hoc - (Cuuduongthancong - Com)Document29 pagesHoa-Dai-Cuong - Nguyen-Son-Bach - Chuong-4-Lien-Ket-Hoa-Hoc - (Cuuduongthancong - Com)buihuonglinhdsNo ratings yet
- Chuong Trinh On Du Kien HHCDocument118 pagesChuong Trinh On Du Kien HHCtranngocanh.ct24102005No ratings yet
- HoaHuucoTP PDFDocument135 pagesHoaHuucoTP PDFDinh Phuc NguyenNo ratings yet
- LIÊN KẾT CỘNG HÓA TRỊ 2019Document101 pagesLIÊN KẾT CỘNG HÓA TRỊ 2019Thuan DucNo ratings yet
- Bài giảng - Cấu tạo chất - Liên kết Hóa họcDocument7 pagesBài giảng - Cấu tạo chất - Liên kết Hóa họcAnh TuanNo ratings yet
- Chuong 2-Cac Liên Ket Cong Hoa Tri Phan Cuc. Acid Va BaseDocument53 pagesChuong 2-Cac Liên Ket Cong Hoa Tri Phan Cuc. Acid Va Baselethithuhat67No ratings yet
- Sach-Giao-Khoa-Hoa-Hoc-Lop-11-Nang-Cao-Đã G PDocument136 pagesSach-Giao-Khoa-Hoa-Hoc-Lop-11-Nang-Cao-Đã G PĐỗ Nam ThànhNo ratings yet
- Bài giảng - Cấu tạo chất - Liên kết Hóa họcDocument7 pagesBài giảng - Cấu tạo chất - Liên kết Hóa học22 03 19 Hoàng Thanh PhúNo ratings yet
- 03-Lien Ket Hoa Hoc Va Cau Tao Phan Tu 211Document55 pages03-Lien Ket Hoa Hoc Va Cau Tao Phan Tu 211Vĩnh Tân TrầnNo ratings yet
- 2. Äại cÆ°Æ¡ng hoá hữu cÆ¡ 2-Các hiá»u ứng Äiá»n tá»Document18 pages2. Äại cÆ°Æ¡ng hoá hữu cÆ¡ 2-Các hiá»u ứng Äiá»n tá»vohoangnhan006No ratings yet
- BG Chương 3 Liên Kết Hóa HọcDocument11 pagesBG Chương 3 Liên Kết Hóa HọcMạnh BùiNo ratings yet
- Hoa-Dai-Cuong - 3 - Lien-Ket-Hoa-Hoc-Revised - (Cuuduongthancong - Com) PDFDocument148 pagesHoa-Dai-Cuong - 3 - Lien-Ket-Hoa-Hoc-Revised - (Cuuduongthancong - Com) PDFAnh PhạmNo ratings yet
- Chuong 2Document43 pagesChuong 2Ngô Thị Mai HoaNo ratings yet
- HHC1 Chuong 1 5 Goi Lop D2018ADocument44 pagesHHC1 Chuong 1 5 Goi Lop D2018AThùy DươngNo ratings yet
- CƠ CHẾ PHẢN ỨNG CƠ BẢNDocument15 pagesCƠ CHẾ PHẢN ỨNG CƠ BẢNThắng Đứcc100% (3)
- Chương 4 - LIÊN KẾT CỘNG HÓA TRỊ VBDocument85 pagesChương 4 - LIÊN KẾT CỘNG HÓA TRỊ VBThiên PhúcNo ratings yet
- Chuyên Đề Điện LyDocument9 pagesChuyên Đề Điện LyVõ Huy HoàngNo ratings yet
- Hoa Dai Cuong Chuong IV Lien Ket Hoa Hoc Va Cau Tao Phan TuDocument20 pagesHoa Dai Cuong Chuong IV Lien Ket Hoa Hoc Va Cau Tao Phan TuLINH HOÀNG NHẬTNo ratings yet
- CẤU TẠO CHẤT - 2Document1 pageCẤU TẠO CHẤT - 2Trang Nguyễn100% (1)
- Bài giảng Phản ứng KLHC nâng cao 1Document7 pagesBài giảng Phản ứng KLHC nâng cao 1Nguyễn Ngọc Xuân NghiêmNo ratings yet
- Vật lí hạt nhânDocument73 pagesVật lí hạt nhânKhoa HoàngNo ratings yet
- chuong 12-Dung dich điện lyDocument4 pageschuong 12-Dung dich điện lyđức trầnNo ratings yet
- 2a.-CHEM1421 Chuong-2 Hi U - NG Unlocked-1Document18 pages2a.-CHEM1421 Chuong-2 Hi U - NG Unlocked-1Duyên NguyễnNo ratings yet
- Lý thuyết Nguyễn Sơn BạchDocument64 pagesLý thuyết Nguyễn Sơn Bạchdat buiNo ratings yet
- Công Phá Hoá tập 2 lớp 11 PDFDocument36 pagesCông Phá Hoá tập 2 lớp 11 PDFlkhungdn100% (1)
- Chuyen de HAT NHAN NGUYEN TUDocument10 pagesChuyen de HAT NHAN NGUYEN TUtqkhanh580No ratings yet
- Hieu Ung eDocument24 pagesHieu Ung eHoàng Gia BaoNo ratings yet
- Hoa-Dai-Cuong - Ly-Thuyet-Lien-Ket-Hoa-Hoc - (Cuuduongthancong - Com)Document4 pagesHoa-Dai-Cuong - Ly-Thuyet-Lien-Ket-Hoa-Hoc - (Cuuduongthancong - Com)long lyNo ratings yet
- TÓM TẮT CHƯƠNG VIDocument2 pagesTÓM TẮT CHƯƠNG VInibbles.mhNo ratings yet
- LK Cong Hoa Tri VB .PPDocument122 pagesLK Cong Hoa Tri VB .PPJacob DavisNo ratings yet
- Hoa-Dai-Cuong Chuong 3 - (Cuuduongthancong - Com)Document26 pagesHoa-Dai-Cuong Chuong 3 - (Cuuduongthancong - Com)Thanh NgânNo ratings yet
- 3 - Dien MoiDocument15 pages3 - Dien Moinguyenphat14032004No ratings yet
- 03 Lien Ket Hoa Hoc Va Cau Tao Phan TuDocument17 pages03 Lien Ket Hoa Hoc Va Cau Tao Phan TuMinh Lê0% (1)
- 28 - 38 Tuong Tac Khong Cong Hoa TriDocument11 pages28 - 38 Tuong Tac Khong Cong Hoa TrifatwuynkNo ratings yet
- Bài 14 - Ôn Tập Chương 31Document18 pagesBài 14 - Ôn Tập Chương 31traitimtuyet172No ratings yet
- C2. Cac Loai Hieu Ung Trong Phan Tu HCHCDocument10 pagesC2. Cac Loai Hieu Ung Trong Phan Tu HCHCNguyễn Hoàng ThịnhNo ratings yet
- TNG HP Hoa Hu CDocument273 pagesTNG HP Hoa Hu CPhú NguyễnNo ratings yet
- 9 Sử Dụng Hợp Chất Cơ Kim Để Tạo Liên Kết C - CDocument15 pages9 Sử Dụng Hợp Chất Cơ Kim Để Tạo Liên Kết C - CHẹhdhff JwjdbfhNo ratings yet
- HatNhanDocument10 pagesHatNhanqminhtran2033No ratings yet
- Chủ Đề 08. Mẫu Nguyên Tử BohrDocument27 pagesChủ Đề 08. Mẫu Nguyên Tử BohrTiến ĐạtNo ratings yet
- Chuong III Hiệu ứng trong hóa hữu cơDocument40 pagesChuong III Hiệu ứng trong hóa hữu cơdoannguyenNo ratings yet
- Hieu Ung CT Va TCDocument12 pagesHieu Ung CT Va TCnam namNo ratings yet
- Tong Hop Hki 10 23 3Document8 pagesTong Hop Hki 10 23 3Nguyen Pham Hoang MinhNo ratings yet
- LT Các Phương Pháp PHDocument3 pagesLT Các Phương Pháp PHPháp TrầnNo ratings yet
- Che8- Liên Kết Vb 2021-SvDocument15 pagesChe8- Liên Kết Vb 2021-SvBAONo ratings yet
- Hoa HC1 Phi PHNG 9Document46 pagesHoa HC1 Phi PHNG 9Đình Thư LêNo ratings yet
- chuong 4 Liên kết hóa họcDocument26 pageschuong 4 Liên kết hóa họcHuy Nguyễn NgọcNo ratings yet
- Hoa Dai Cuong Chuong IV Lien Ket Hoa Hoc Va Cau Tao Phan TuDocument20 pagesHoa Dai Cuong Chuong IV Lien Ket Hoa Hoc Va Cau Tao Phan Tubambooinyou24627No ratings yet
- HIỆU ỨNG CẤU TRÚC HUONGDocument27 pagesHIỆU ỨNG CẤU TRÚC HUONGThắng ĐứccNo ratings yet
- Chuong 2Document38 pagesChuong 2minh quang tôNo ratings yet
- chuong 12-Dung dich điện lyDocument4 pageschuong 12-Dung dich điện lyQuoc Bao NguyenNo ratings yet
- Orbitan Phân T & Mũi Tên CongDocument101 pagesOrbitan Phân T & Mũi Tên CongPhan Khoa100% (1)
- Chương 4. Tính Dẫn Điện Của Dung Dịch Điện LyDocument38 pagesChương 4. Tính Dẫn Điện Của Dung Dịch Điện LyThùy Trang0% (2)
- Dien-Va-Tu - Huynh-Truc-Phuong - Baigiang - Dien-Va-Tu - Chuong-3-Dien-Moi - (Cuuduongthancong - Com)Document15 pagesDien-Va-Tu - Huynh-Truc-Phuong - Baigiang - Dien-Va-Tu - Chuong-3-Dien-Moi - (Cuuduongthancong - Com)lcongmanh1511611No ratings yet
- BME_232_Ch02 - Biopotential ElectrodesDocument79 pagesBME_232_Ch02 - Biopotential ElectrodesVŨ VÕ NGUYÊNNo ratings yet
- Bai Giang CH3220 Chương 3 Hieu Ung Trong HCHCDocument36 pagesBai Giang CH3220 Chương 3 Hieu Ung Trong HCHCMinhAnh0% (1)
- CHE8- liên kết VB-SVDocument15 pagesCHE8- liên kết VB-SVTri NguyenNo ratings yet
- Chương 3 - lý ThuyếtDocument4 pagesChương 3 - lý ThuyếtnguyenthinhvinhkhaNo ratings yet
- Tổng hợp hữu cơ được thúc đẩy bởi trí tuệ nhân tạoDocument16 pagesTổng hợp hữu cơ được thúc đẩy bởi trí tuệ nhân tạoĐặng Thiên PhướcNo ratings yet
- Hóa Học Acid Nucleic (Thầy Thái)Document29 pagesHóa Học Acid Nucleic (Thầy Thái)Đặng Thiên PhướcNo ratings yet
- GLUDCID CompressedDocument66 pagesGLUDCID CompressedĐặng Thiên PhướcNo ratings yet
- 24 511226372 Hoàng Trần Bảo Phúc DCQ2022C 02082004Document8 pages24 511226372 Hoàng Trần Bảo Phúc DCQ2022C 02082004Đặng Thiên PhướcNo ratings yet
- 24-511226379-Đặng Thiên Phước-D22-11012004Document5 pages24-511226379-Đặng Thiên Phước-D22-11012004Đặng Thiên PhướcNo ratings yet
- Đ I Cương Đơn BàoDocument15 pagesĐ I Cương Đơn BàoĐặng Thiên PhướcNo ratings yet
- Bài giảng - chương 1.1Document2 pagesBài giảng - chương 1.1Đặng Thiên PhướcNo ratings yet
- VC Nhom ADocument103 pagesVC Nhom AĐặng Thiên PhướcNo ratings yet
- BÁI 1. CÁCH SỬ DỤNG KÍNH HIỂN VI PHƯƠNG PHÁP CẮT-NHUỘM-VẼ VI PHẪU PHƯƠNG PHÁP THỰC HIỆN TIÊU BẢN THỰC VẬTDocument4 pagesBÁI 1. CÁCH SỬ DỤNG KÍNH HIỂN VI PHƯƠNG PHÁP CẮT-NHUỘM-VẼ VI PHẪU PHƯƠNG PHÁP THỰC HIỆN TIÊU BẢN THỰC VẬTĐặng Thiên PhướcNo ratings yet
- Lá Hoa (1 Phần) - Ths.lâmDocument45 pagesLá Hoa (1 Phần) - Ths.lâmĐặng Thiên PhướcNo ratings yet
- $thân Cây - 2022Document82 pages$thân Cây - 2022Đặng Thiên PhướcNo ratings yet
- Tóm Tắt Phép ChiTZDocument2 pagesTóm Tắt Phép ChiTZĐặng Thiên PhướcNo ratings yet
- - Đề thi giữa kỳ Vật lý đại cương DCQ22 Khối C Tổ 24Document159 pages- Đề thi giữa kỳ Vật lý đại cương DCQ22 Khối C Tổ 24Đặng Thiên PhướcNo ratings yet
- Vật lý đại cương Cơ học chất lưu 2022 bản rút gọn HandoutDocument23 pagesVật lý đại cương Cơ học chất lưu 2022 bản rút gọn HandoutĐặng Thiên PhướcNo ratings yet