Professional Documents
Culture Documents
Izpiski Nova Snov (Matura)
Uploaded by
Meta ŠvageljOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Izpiski Nova Snov (Matura)
Uploaded by
Meta ŠvageljCopyright:
Available Formats
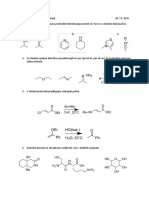
KEMIJA – IZPISKI (NOVA SNOV – MATURA)
5. ORGANSKE DUŠIKOVE SPOJINE
5.1: AMINI
5.1.1: Primarni, sekundarni in terciarni amini
Organizmi potrebujejo dušik za tvorbo organskih spojin
Elementarnega dušika (N2) je v ozračju ogromno, a ga lahko iz zraka vežejo le
nekateri mikroorganizmi
Človek lahko dobi dušikove spojine le iz hrane
Vrste organskih dušikovih spojin:
* nitrobenzen
* amidi (CONH2)
* nitrili (CN)
* imini
* hidrazini
* hidrazoni
* amini
AMINI:
* so organski derivati amonijaka
* glede na število substituentnih skupin, vezanih na dušikov atom, jih delimo na
primarne (na N vezana ena organska substituentna skupina), sekundarne (dve
organski substituentni skupini) in terciarne (tri organske substituentne skupine)
* imenovanje: navedemo število in vrsto organskih substituentnih skupin ter dodamo
končnico »amin« (brez presledka)
* simetrični amini – če so organske substituentne skupine enake
* nesimetrični amini – če so organske substituentne skupine različne
* lahko jih imenujemo tudi s predpono »amino«
5.1.2: Lastnosti aminov
So derivati amonijaka, zato so bazične spojine
Alifatski amini (npr. etilamin) so nekoliko močnejše baze kot amonijak, aromatski
amini (npr. anilin) pa šibkejše baze kot amonijak
Amini so šibkejše baze kot hidroksidi kovin 1. In 2.skupine PS
PROTOLITSKE REAKCIJE amonijaka in aminov z vodo so podobne
*CH3CH2NH2 + H2O --- CH3CH2NH3+ (etilamonijev ion) + OH-
REAKCIJE AMINOV Z MOČNIMI KISLINAMI (npr. s HCl) nastanejo
amonijeve soli
* CH3CH2NH2 (aq) + HCl (aq) CH3CH2NH3+Cl- (etilamonijev klorid)
* reakcija aminov s klorovodikovo kislino je učinkovit načinn pretvorbe slabotopnih
aminov v vodotopne amonijeve soli
* amonijevo sol lahko pretvorimo nazaj v amin z dodatkom raztopine močne baze
(npr. NaOH)
TOPNOST AMINOV V VODI:
* amini so polarni; nižji amini so dobro topni v vodi, z daljšanjem verige C atomov pa
se topnost aminov v vodi manjša
* amini tvorijo vodikove vezi z molekulami vode
VRELIŠČE AMINOV:
* z daljšanjem verige C atomov se vrelišče amina viša
* primarni amini imajo višja vrelišča kot s izomerni ekundarni amini, najnižja
vrelišča pa imajo izomerni terciarni amini
> primarni amini imajo na N atom vezana 2 H atoma, ki se lahko s sosednjimi
molekulami povezujeta preko vodikovih vezi zato najvišja vrelišča
> terciarni amini nimajo nobenega H atoma zato najnižja vrelišča
* primarni amini imajo nižja vrelišča kot alkoholi in karboksilne skupine, a višja
kot manj polarne in nepolarne organske spojine podobnih molskih mas (npr. etri
in ogljikovodiki, ki ne morejo tvoriti vodikovih vezi)
* karboksilna k. > alkohol > primarni amin > eter > alkan
5.1.3: Nastanek in pretvorbe aminov
Primarni amini nastanejo pri reakcijah halogenov z amonijakom
(NUKLEOFILNA SUBSTITUCIJA)
* nastale primarne amine lahko z nadaljnimi reakcijami s halogenoalkani pretvorimo v
sekundarne in terciarne amine
Primarne amine dobimo tudi z redukcijo drugih dušikovih organskih spojin (npr.
nitrilov, amidov in nitro spojin); pri tem uporabljamo po navadi vodik s katalizatorjem
(katalitsko hidrogeniranje)
* Nitrobenzen + H2/Ni anilin
* propannitril + H2/Ni propilamin
DIAZOTIRANJE AROMATSKIH AMINOV:
* nastanejo diazonijeve soli, iz katerih lahko pripravimo številne aromatske spojine
> zmesi aromatskega amina in HCl v hladnem dodamo NaNO2 HNO2, ki
pretvori anilin v benzendiazonijev klorid (diazonijeva sol)
> benzendiazonijev klorid lahko pripojimo na nekatere aromatske spojine
(fenole, aniline) pri tem nastanejo »azo spojine« z – N=N skupino (azo
skupina)
> nekatere azo spojine uporabljamo kot barvila
> DIATONIZIRANJE alifatskih aminov nima sinteznega pomena, ker so alifatske
diazonijeve soli nestabilne! (razpadejo na dušik in zmes različnih produktov)
5.2: AMINOKISLINE
5.2.1: Spojine z amino in karboksilno skupino
Aminokisline so najpomembnejše organske dušikove spojne
Vse naravne AK vsebujejo C,H,O in N atome; nekatere pa imajo tudi atome drugih elementov
SPLOŠNA FORMULA AK:
* osrednji C atom, na katerega so vezane amino skupina (NH2), karboksilna skupina (COOH),
radikal in H atom
2 najpreprostejši AK: glicin (2-aminoetanojska kislina) in alanin (2-aminopropanojska
kislina)
* glicin in alanin uvrščamo med - aminokisline (amino skupina je vezana na drugi ogljikov
atom!; ogljikov atom v COOH skupini ima številko 1)
* večina AK v živih organizmih je - aminokislin
* glicin nima centra kiralnosti, alanin pa ga ima
* večina - aminokislin je L- aminokislin (D- aminokisline so redke)
FISHERJEVO PROJEKCIJSKO FORMULO aminokislin pišemo tako, da verigo C-atom
usmerimo navpično navzdol, s COOH skupino na vrhu
* usmerjenost amino skupine glede na verigo C atomov (levo oz. desno) opredelimo z L- in
D-
L- alanin in D-alanin sta druga drugi zrcalni sliki, torej sta enantiomera
Aminokisline lahko razvrščamo glede na KISLOST oz. BAZIČNOST stranske verige:
* nevtralne (ena amino in ena COOH skupina)
* kisle (dodatna COOH skupina)
* bazične (dodatna NH2 skupina)
5.2.2: Oblika aminokisline
AK lahko reagirajo kot kisline (oddajo vodikov ion) ali kot baze (sprejmejo vodikov
ion) – pravimo, da so AMFOTERMNE
V trdnem agregatnem stanju se AK nahaja v obliki iona dvojčka (vodikov ion iz
kisle karboksilne skupine preide na bazično amino skupino)
AK imajo visoka tališča
Oblika AK je odvisna od PH raztopine, v kateri se nahaja in od narave AK:
* močno kisla raztopina prevladuje kationska oblika (ion dvojček sprejme en
vodikov ion na COO- skupino)
* močno bazična raztopina prevladuje anionska oblika (ion dvojček odda en
vodikov ion iz NH3+ skupine)
IZOELEKTRIČNA TOČKA (pI) je pH vrednost, pri kateri je koncentracija iona
dvojčka največja (konc. kationske in anionske oblike pa enaki)
* bazične AK izoelektrična točka več kot 7
* kisle AK izoelektrična točka manj kot 7
* nevtralne AK različno
* v izoelektrični točki je topnost AK najmanjša
Če je pH raztopine manjši kot izoelektrična točka AK (bolj kisla raztopina), se AK
nahaja pretežno v kationski obliki
Če je pH raztopine večji kot izoelektrična točka AK (bolj bazična raztopina), se AK
nahaja pretežno v anionski obliki
Na osnovi razlik v izoelektričnih točkah lahko ločujemo zmes AK metoda
ločevanja v električnem polju se imenuje ELEKTROFOREZA
* pod vplivom enosmernega električnega toka skozi raztopino se AK v kationski obliki gibljejo
k negativni elektrodi (katodi), AK v anionski obliki pa k pozitivni elektrodi (anodi). AK v
obliki iona dvojčka mirujejo. Razlike se pojavijo tudi v hitrosti gibanja
Raztopine AK so brezbarvne
* za dokazovanje jih obarvano z ninhidrinom (ta reagira z večino -AK, pri tem nastanejo
vijolično obarvani produkti)
ESENCIALNE AK: tiste, ki jih telo ne zna narediti, zato jih moramo zaužiti s hrano
(esencialnih AK je 10)
5.2.3: Povezovanje aminokislin
Iz AK lahko nastanejo večje molekule – peptidi (dipeptid, tripeptid…)
OLIGOPEPTIDI = peptidi z nekaj aminokislinskimi enotami
POLIPEPTIDI = vsebujejo veliko število aminokislinskih enot
V molekulah BELJAKOVIN je lahko vezanih več 1000 aminokislinskih enot
* AK se lahko povezujejo na različne načine in v različno dolge verige
PROTEINOGENE AMINOKISLINE – gradijo beljakovine
Reakcija med dvema AK:
* odcepi se molekula vode iz karboksilne in amino skupine
* CONH = amidna vez (amidna skupina); ker se AK povežejo v peptid, pa za
skupino CONH atomov uporabljamo izraz peptidna vez
Mednarodno dogovorjene tričrkovne oznake AK za hitrejše zapisovanje peptidne
verige
Pri povezovanju AK v peptide je pomemben vrstni red!
KONDENZACIJA = reakcija pri kateri nastane večja molekula z odcepom manjše
molekule (vode)
* če se na ta način poveže veliko št. molekul, govorimo o polikondenzaciji
* AK se povezujejo v beljakovine s polikondenzacijo
Vsi štirje atomi peptidne vezi so v isti ravnini
* vez med C in N atomom je delno dvojna, zaradi česar je onemogočena vrtljivost
okoli te vezi posledica: planarna zgradba peptidne vezi
*med verigami peptidov nastanejo VODIKOVE VEZI!!!!! (med O in H atomom
peptidnih vezi)
Posebna povezava peptidnih verig: disulfidni most (disulfidna vez) – kovalentna vez
preko dveh žveplovih atomov, ki jo omogočita dve enoti aminokisline cistein
INSULIN (polipeptid, ki ga izloča pankreas; uravnava nivo glukoze v krvi; sestavljen
je iz dveh peptidnih verig, ki sta med seboj povezani z dvema disulfidnima mostovoma)
Peptide dokažemo z biuretsko reakcijo:
* beljakovini dodamo CuSO4 in NaOH pojavi se značilno vijolično obarvanje
Peptide lahko HIDROLIZIRAMO – razgradimo na posamezne AK (v močno kislem
ali bazičnem, ali s pomočjo določenih encimov)
5.2.4: Delitev in vloga beljakovin
Beljakovine se razlikujejo v številu, vrsti in zaporedju vezanih AK
Glede na sestavo jih delimo na:
*enostavne beljakovine (proteini) – zgrajene le iz AK enot; npr. kolagen (v hrustancu in koži)
* sestavljene beljakovine (konjugirane beljakovine)- poleg peptidne verige vsebujejo
tudi nebeljakovinski del; npr. hemoglobin, kazein (v mleku)
Glede na obliko:
* nitaste
* kroglaste
VLOGE BELJAKOVIN V ŽIVIH BITJIH:
* gradijo različna tkiva (mišice, kosti… - npr. beljakovini keratin in kolagen)
* so sestavni del celičnih membran in jeder (histoni)
* sodelujejo v obrambi organizma (protitelesa) pred različnimi boleznimi
* prenašajo snovi po organizmu (npr. hemoglobin prenaša kisik do celic)
* pospeševalci kemijskih reakcij (encimi in hormoni; npr. pepsin in amilaza)
* so vir AK, ki jih organizem uporabi za nastanek novih beljakovin
* so vir energije če zmanjka ogljikovih hidratov in maščob
Jajčni beljak pri segrevanju zakrkne – koagulira (iz brezbarvne tekočine nastane bela
trdna snov); koagulacija je posledica spremembe strukture beljakovin
DENATURACIJA – ko beljakovina izgubi svojo biološko aktivnost (povzročijo jo
različne kisline, baze, soli težkih kovin, povišana T)
ZGRADBA BELJAKOVIN:
* primarna – zaporedje AK
* sekundarna – zvijanje posameznih delov peptidne verige (npr. v vijačnico)
* terciarna – prostorska ureditev peptidne verige
* kvartarna – povezovanje dveh ali več podenot v funkcionalno beljakovino
6. POLIMERI
6.1: ADICIJSKI POLIMERI
6.1.1: Vrste polimerizacij
POLIMERIZACIJA = kemijska reakcija, pri kateri se več manjših molekul poveže v
večjo molekulo
* manjša molekula, ki se poveže v večjo = monomer
* makromolekula, ki nastane pri polimerizaciji = polimer (zgrajena iz veliko monomerov)
DVE VRSTI POLIMERIZACIJE:
* adicijska polimerizacija (poliadicija)
> značilna za nenasičene spojine (alkene in alkine)
> podobna adicijam
> monomeri (nenasičene spojine) se zgolj povežejo v večjo molekulo, pri čemer se
prekinejo multiple vezi v njihovih molekulah
* kondenzacijska polimerizacija (polikondenzacija)
> pri povezovanju monomerov v polimer se odcepi manjša molekula (pogosto voda)
6.1.2: Adicijska polimerizacija
Polimeri nastajajo tudi v naravi (polisaharide in polipeptide uvrščamo med kondenzacijske
polimere)
Umetno izdelani polimeri – poljudno jih imenujemo PLASTIKA
* večina umetnih adicijskih polimerov nastane s polimerizacijo preprostih alkenov (npr. eten,
propen)
NAJPOMEMBNEJŠI ADICIJSKI POLIMERI:
* POLIETEN ali POLIETILEN
> nastane s polimerizacijo etena
> uporabljamo različne katalizatorje
> uporabljamo ga za izdelavo različne embalaže (vrečke, posode) –
mednarodna oznaka = PE
> dobro kemijsko odporen pri sobni T, tališče nad 100stopinj, pri povišani T se
raztaplja v nekaterih ogljikovodikih (toluen) in halogeniranih ogljikovodikih
> s črko »n« poudarimo, da se monomerni del velikokrat ponovi!
* POLIPROPEN ali POLIPROPILEN:
> nastane s polimerizacijo prioena
> za izdelavo različne embalaže, vrvi, zaščitnih oblačil, igrač, za bankovce
> velika kemijska odpornost
> mednarodna oznaka: PP
* POLI (KLOROETEN) ali poli (VINIL KLORID)
> mednarodna oznaka: PVC
> nastane s polimerizacijo kloroetena
> za izolacijo živ, izdelavo cevi, dežnih plaščev…
* POLI (TETRAFLUOROETEN) ali TEFLON:
> okrajšava: PTFE
> nastane s polimerizacijo tetrafluoroetena
> kemijsko zelo odporen
> snov za prevleko kuhinjske posode, za izdelavo posod, v katerih lahko
shranjujemo zelo reaktivne in korozivne kemikalije, za izdelavo tesnil
* POLI (FENILETEN) ali POLISTIREN
> s polimerizacijo stirena dobimo polistiren (oznaka PS)
> za izdelavo embalaže (jogurtovi lončki), kot izolacijski material (stiropor)
> dober toplotni izolator
Drugi adicijski polimeri:
* pleksi steklo (monomer je metil 2-metilpropenoat)
KAVČUK = pomemben naravni polimer, a pridobivajo ga tudi umetno
* polimer izopropena ali 2-metilbuta – 1,3 – diena
Shema polimerizacije 2 – klorobuta – 1,3 – iena, pri kateri nastane polimer »neopropen«:
> pri polimerizaciji dienov pride do premestitve dvojnih vezi
6.2: KONDENZACIJSKI POLIMERI
6.2.1: Kondenzacijska polimerizacija
Sem uvrščamo POLIESTRE in POLIAMIDE
* uporabljamo ju v tekstilni industriji
* za poliestre je značilna estrska skupina (-COO-), za poliamide pa amidna (-CONH-)
POLIAMIDI:
* NARAVNI POLIAMIDI: polipeptidi in beljakovine
* UMETNO NAREJENI POLIAMIDI
* nahajajo se v najlonskih vlaknih, v kevlarju za izdelavo neprebojnih jopičev, vrveh,
jadrih, mrežah
POLIESTRI:
* najbolj razširjen je poli(etilen tereftalat) ali krajše PET (dobro je odporen na različne
kemikalije, ne povzroča alergij in ni vnetljiv)
* nastanek PET:
»POLIKARBONATI« - nastanejo s kondenzacijsko polimerizacijo in vsebujejo
funkcionalno skupino –O-CO-O- (za izdelavo različnih stekel, nosilcev za CD, DVD plošče)
POLIAMIDI:
* najlon 6,6 – v tekstilni industriji (najlonke), tudi za izdelavo vrvi, preprog
* kevlar (v strukturi ima benzenove obroče) – za izdelavo vojaških čelad, neprebojnih
jopičev, za izdelavo zaščitnih oblek za gasilce (odporen na višje T); vzrok teh
izjemnih lastnosti so vodikove vezi
Mnogi umetno narejeni polimeri:
* bolj odporni na zunanje vplive kot naravni polimeri dlje časa obstojni in uporabni
* težje razgradljivi v naravi, njihov razkroj je počasen
* recikliranje nekaterih polimerov, a zaradi njihove raznolikosti je ločevanje zamudno
in drago (na plastični embalaži najdemo tudi znak za recikliranje, pod znakom pa je črkovna
oznaka polimera)
You might also like
- GogiDocument5 pagesGogiOskar MerkunNo ratings yet
- Matura Esej IzpiskiDocument2 pagesMatura Esej IzpiskithechonkyboizNo ratings yet
- Hormoni RešitveDocument5 pagesHormoni RešitveIrina VehovecNo ratings yet
- Obnove Dejanj Velikega Briljantnega ValčkaDocument13 pagesObnove Dejanj Velikega Briljantnega ValčkalupsaunaNo ratings yet
- KEMIJADocument24 pagesKEMIJACristine Gran100% (1)
- Šalabahter KemijaDocument2 pagesŠalabahter KemijaLuka Šimić100% (1)
- Motivno-tematska in Slogovno-zgradbena Analiza VBVDocument7 pagesMotivno-tematska in Slogovno-zgradbena Analiza VBVTaNja VZNo ratings yet
- Organska KemijaDocument126 pagesOrganska KemijaKrasic IvanNo ratings yet
- Ogljikovodiki Moja VerzijaDocument17 pagesOgljikovodiki Moja Verzijalanfridrih3No ratings yet
- Fischerova EsterifikacijaDocument5 pagesFischerova EsterifikacijaAntonio SabljićNo ratings yet
- OK I Zapiski Predavanj 2013 2014Document81 pagesOK I Zapiski Predavanj 2013 2014Crt SuznikNo ratings yet
- Organska KemijaDocument14 pagesOrganska KemijaNina MajorancNo ratings yet
- Vrste Reakcija I Nomenklatura Organskih SpojevaDocument16 pagesVrste Reakcija I Nomenklatura Organskih SpojevaMichaelEyedeaLarsenNo ratings yet
- Priprema Za ČasDocument7 pagesPriprema Za ČasAmila MulahalilovićNo ratings yet
- Biokemija 1Document25 pagesBiokemija 1Alen Ksoll100% (1)
- Organska Kemija - SkriptaDocument47 pagesOrganska Kemija - SkriptalaraNo ratings yet
- Organska KemijaDocument122 pagesOrganska KemijaMarijan MedvedNo ratings yet
- Organska KemijaDocument31 pagesOrganska Kemijarenegton94No ratings yet
- Alkalijski MetaliDocument6 pagesAlkalijski MetaliMariaNo ratings yet
- Mislej, Naše skladišče po dejanjihDocument17 pagesMislej, Naše skladišče po dejanjihTaNja VZNo ratings yet
- Organsko-Kemijske Reakcije. Rezonancija.Document26 pagesOrgansko-Kemijske Reakcije. Rezonancija.hjNo ratings yet
- Ivan Cankar: Hlapec Jernej in Njegova PravicaDocument2 pagesIvan Cankar: Hlapec Jernej in Njegova PravicaTaja PodgorsekNo ratings yet
- 3P-Struktura Organskih Molekula PDFDocument8 pages3P-Struktura Organskih Molekula PDFElvir MNo ratings yet
- Biokemija 2Document20 pagesBiokemija 2Alen Ksoll100% (1)
- ObnoveDocument4 pagesObnoveWrathNo ratings yet
- Na Vrtu Pred Županovo KrčmoDocument7 pagesNa Vrtu Pred Županovo KrčmoTaja PodgorsekNo ratings yet
- KEMIJA - VODIK, Skripta, 4. Razred GimnazijeDocument9 pagesKEMIJA - VODIK, Skripta, 4. Razred GimnazijePaolaNo ratings yet
- Kiseonicne Kiseline Halogenih ElemenataDocument6 pagesKiseonicne Kiseline Halogenih ElemenataТатјана Ристић100% (1)
- 1. СПЕЦИФИЧНИ ФИЗИЧКО-ХЕМИСКИ ОСОБИНИDocument36 pages1. СПЕЦИФИЧНИ ФИЗИЧКО-ХЕМИСКИ ОСОБИНИAlen VukosavljevicNo ratings yet
- Klasifikacija Neorganskih Jedinjenja 1Document54 pagesKlasifikacija Neorganskih Jedinjenja 1Maja DjordjevicNo ratings yet
- Poročilo Bilogija-Alkoholno VrenjeDocument7 pagesPoročilo Bilogija-Alkoholno VrenjeselebajzerNo ratings yet
- Eksistencializem Camus SartreDocument60 pagesEksistencializem Camus SartreGregor RozmanNo ratings yet
- Nukleinske Kiseline - ScribdDocument20 pagesNukleinske Kiseline - ScribdGoran100% (1)
- Test Za Prva Godina Od Gradba Na AtomDocument1 pageTest Za Prva Godina Od Gradba Na AtomDamjan VasilevskiNo ratings yet
- ZBIRKA 4r - ORGANSKA KEMIJA - ŠKOLSKA KNJIGA 2013Document146 pagesZBIRKA 4r - ORGANSKA KEMIJA - ŠKOLSKA KNJIGA 2013BirdKokiNo ratings yet
- Ta Veseli Dan Ali Matiček Se ŽeniDocument2 pagesTa Veseli Dan Ali Matiček Se ŽeniAna MetličarNo ratings yet
- ModernaDocument20 pagesModernaInes ČučekNo ratings yet
- Lastnosti in Zgradba Trdnih SnoviDocument31 pagesLastnosti in Zgradba Trdnih Snoviluka bevkNo ratings yet
- Aminokiseline I Proteini Za 5Document56 pagesAminokiseline I Proteini Za 5Pavle DujkicNo ratings yet
- XVIII - Alkaloidi 1Document127 pagesXVIII - Alkaloidi 1api-38143890% (1)
- Proteini I Amino-Kis.Document23 pagesProteini I Amino-Kis.GoranNo ratings yet
- Organska Kemija 2 - Slovenacki JezikDocument181 pagesOrganska Kemija 2 - Slovenacki JezikDejan MiticNo ratings yet
- 14 AK Kisline Baze Nevodna TopilaDocument32 pages14 AK Kisline Baze Nevodna TopilaMarija KovačevićNo ratings yet
- Za Objavo Odgovori 6 Ogljikovodiki S PolimeriDocument14 pagesZa Objavo Odgovori 6 Ogljikovodiki S PolimeriLan GorencNo ratings yet
- Farmaceutska Kemija 1Document103 pagesFarmaceutska Kemija 1Mateja100% (2)
- Organska Kemija 2Document12 pagesOrganska Kemija 2Antonio SabljićNo ratings yet
- Organska KemijaDocument159 pagesOrganska KemijaMr MNo ratings yet
- Ogljikovodiki PonavljanjeDocument6 pagesOgljikovodiki PonavljanjerefswNo ratings yet
- KEMIJA - Alkani, Cikloalkani, Alkeni - TeorijaDocument3 pagesKEMIJA - Alkani, Cikloalkani, Alkeni - TeorijaLuka Bartolic0% (1)
- Vprašanja Z Odgovori, KemijaDocument7 pagesVprašanja Z Odgovori, KemijaMonikaGrajNo ratings yet
- Izpitna Vprasanja Z OdgovoriDocument48 pagesIzpitna Vprasanja Z OdgovoriBoko LokoNo ratings yet
- Hemiski Znaci I Formuli-Hemiski SoedinenijaDocument28 pagesHemiski Znaci I Formuli-Hemiski SoedinenijaJordan Nelkovski100% (1)
- Zbirka Nalog Za Izpit Farmacevtska Kemija 1Document13 pagesZbirka Nalog Za Izpit Farmacevtska Kemija 1Neža MikeljNo ratings yet
- Pomen Variiranja SubstituentovDocument26 pagesPomen Variiranja Substituentovapi-3814389No ratings yet
- Bioorganska Seminarji2021Document8 pagesBioorganska Seminarji2021Gašper MožinaNo ratings yet
- 1-Teorii Za Kiselini I BaziDocument39 pages1-Teorii Za Kiselini I BaziDusko MatejicNo ratings yet
- Stabilnost ZdravilDocument9 pagesStabilnost ZdravilŠpela StrgarNo ratings yet
- Ionske Reakcije - Reakcije Med Ioni V RaztopiniDocument11 pagesIonske Reakcije - Reakcije Med Ioni V Raztopini6rmtd52h84No ratings yet
- 7 Chapter PDFDocument21 pages7 Chapter PDFIvicaNo ratings yet
- Biokemija - PregledDocument54 pagesBiokemija - PregledŽiva Zidar UriskNo ratings yet