Professional Documents
Culture Documents
Báo Cáo Hóa H U
Uploaded by
Nguyễn Huỳnh Vân ThanhOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Báo Cáo Hóa H U
Uploaded by
Nguyễn Huỳnh Vân ThanhCopyright:
Available Formats
BÁO CÁO THÍ NGHIỆM HÓA HỮU CƠ
Bài 3 : Phản Ứng Ester Hóa-Tổng Hợp Aspirin
A. PHẦN RIÊNG CHO MỖI SINH VIÊN: 5 điểm
(Chuẩn bị trước khi thí nghiệm)
Họ Tên:Nguyễn Huỳnh Vân Thanh MSSV:62000894 Nhóm:04
Họ tên:Phan Huỳnh Bảo Trân MSSV:62000922 Nhóm :04
Họ Tên:Lê Nguyễn Bảo Trang MSSV:62000927 Nhóm:04
Ngày Thực hành: 28/8/2022
Điểm Lời phê
1.Mục đích
- Củng cố kiến thức phản ứng ester hóa dẫn xuất của phenol.
- Tiến hành tổng hợp aspirin thông qua phản ứng ester hóa dẫn xuất của phenol.
- Quan sát hiện tượng và kiểm tra lại kiến thức trong báo cáo.
2. Thực hành
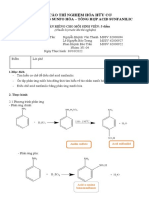
2.1 Phương trình phản ứng
H3PO4
Acid salycilic Anhydride acetic
Acid acetyl salycilic
ASPIRIN
2.2 Bảng tính chất vật lý*
K/l p/tử Nhiệt N/độ nóng Tỷ
Hóa chất-Sản phẩm (g/mol) độ sôi chảy (oC) trọng Tính chất/Độc tính
(oC) (g/ml)
138 211 158,6 1,44 -Acid salicylic là một acid
Acid salycilic β-hydroxy hay còn được biết
C7H6O3 đến với tên gọi khác là BHA.
Ngoài ra còn có α-hydroxy Acid
salicylic là một acid β-hydroxy hay
còn được biết
đến với tên gọi khác là BHA.
Ngoài ra còn có α-hydroxy – có tác
dụng làm sạch
nhẹ nhàng trên da, giúp làm
mịn, tẩy tế bào chết và làm
đều màu da
-Dễ thấm qua da và đi vào máu.
Có thể gây ung thư do tăng
tính nhạy cảm của da dưới tác
dụng của tia UV. Gây hen
suyễn, hội chứng Reye
- Là một chất lỏng không màu
Anhydride acetic 102 139.8 -73.1 1.08 có mùi acid acetic mạnh, được
(CH3CO)2O hình thành do phản ứng của nó
với độ ẩm trong không khí
- Gây độc hại cho phổi, niêm
mạc mắt
Acid photphoric 97.994 158 21 1.88 - Là acid ở dạng lỏng, không
H3PO4 màu, không mùi và sánh.
- Độc tính cấp qua đường
miệng, nếu nuốt phải gây bỏng
miệng và họng. Kích ứng
màng nhầy, ho, khó thở. Gây
bỏng da và kích ứng mắt
- Có màu nâu đen, mùi đặc
Iron (III) chloride 162.5 315 306 2.9 trưng và có độ nhớt cao. Tan
FeCl3 được trong nước, methanol,
ethanol và các dung môi khác.
- Tiếp xúc mắt gây nguy hại,
lảm hỏng giác mạc, gây mù.
Hít phải gây ho, hắt hơi, tổn
thương phổi
- Không màu , dễ cháy, dễ bay
46.07 78.4 0.812 hơi, hút ẩm, tan vô hạn trong
Ethanol nước, tan trong ete, clorofom
C2H5OH - Không màu , dễ cháy, dễ bay
hơi, hút ẩm, tan vô hạn trong
nước, tan trong ete, clorofom
60 118.8 16.6 1.05 - Là chất lỏng không màu có vị
chua, là một acid yếu. Còn gọi
Acid acetic là dấm công nghiệp, có tính ăn
CH3COOH mòn kim loại như sắt, mangan
và kẽm.
- Aspirin là tinh thể hình kim
không màu hoặc bột kết tinh
trắng, thoảng có mùi acid
Aspirin 180 140 138 1.04 acetic, vị chua, dễ hút ẩm và bị
C9H8O4 phân huỷ tạo thành acid
salicylic và acid acelic, khó
tan trong nước, dễ tan trong
ethanol, dung dịch kiềm và
carbonat kiềm. Ứng dụng ở
phẩn trả lời câu hỏi
* The Merck Index
2.3 Tính hiệu suất:
Ta có:
Số mol acid salycilic là:
macid salycilic 5
nacidsalycilic= M acid salycilic = 138 =0.036mol
Số mol anhydride acetic là:
v ❑ ×d ❑
1.08× 10
nanhydride acetic = anhydrideMacetic anhydride acetic = 120 =0.105mol
❑
anhydride acetic
H3PO4
Phương trình phản ứng theo tỉ lệ 1:1 nanhydride acetic dư.
naspirin = nacid salycilic = 0.036 mol
Khối lượng aspirin lý thuyết là:
maspirin lý thuyết = naspirin x Maspirin = 0.036 x 180 = 6.48g
maspirin thực tế
❑
6.84
H% = x100% = x100%=105.5%
maspirinlý thuyết
❑ 6.48
2.4 Hình vẽ lắp ráp dụng cụ: Đun hồi lưu và chưng cất
2.5 Sơ đồ thí nghiệm
3. Trả lời câu hỏi
1. Thay H3PO4 đậm đặc bằng H2SO4 đậm đặc được không.
Có thể thay H3PO4 đậm đặc bằng H2SO4 đậm đặc được vì H2SO4 cũng có tính acid. Đồng thời
acid sulfuric cũng có khả năng proton hóa nguyên tử [O] trong anhydride acid.
2. Cho biết các tác nhân ester hóa dẫn xuất phenol thường gặp, so sánh vận tốc phản ứng của các
tác nhân đó với dẫn xuất phenol
Các tác nhân ester hóa dẫn xuất phenol thường gặp là:
- Với clorua acid:
-
- Với anhydride acid:
- Tuy nhiên khi có mặt nhóm carboxyl trong nhân benzen, ta cần tiến hành trong môi trường khan nước
bằng cách thêm H2SO4 hoặc H3PO4.
- So sánh vận tốc phản ứng: RCO-X > (RCO)2O
3. Cho biết cách tinh chế sản phẩm. Giải thích
- Hòa tan tinh thể với lượng ethanol tối thiểu cần thiết (nhỏ từ từ cho đến khi tinh thể tan hoàn toàn và
thu được dung dịch trong suốt). Tiếp tục thêm nước ấm vào đến khi dung dịch chuyển sang vẫn đục.
Lại thêm từ từ từng giọt ethanol vào đến khi thu được dung dịch trong suốt. Làm lạnh dung dịch để kết
tinh và lọc thu tinh thể.
- Vì sau khi hòa tan với ethanol và nước ấm, aspinrin sẽ tan ra và có bao gồm cả acid salycilic thoát
ra.Nên sau khi rửa và làm lạnh, aspirin sẽ kết tinh lại và tinh khiết hơn.
4. Tại sao phải thử bằng FeCl3. Màu tím xuất hiện là do nguyên nhân gì?
- Mục đích của việc thử dung dịch bằng FeCl3 là để xem acid salycilic còn lẫn trong sản phẩm cần thu
hay không để ta có thể rửa và thu sản phẩm tinh khiết.
- Màu tím xuất hiện là do Fe3+ sẽ tạo phức với dẫn xuất của phenol là acid salicilic tạo màu tím:
- Ar-OH + FeCl3 Ar-OFeCl2 (màu tím) + HCl
5. Các yếu tố ảnh hưởng đến hiệu suất sản phẩm? Biện luận? Yếu tố nào quan trọng nhất?
- Các yếu tố ảnh hưởng đến hiệu suất sản phẩm: độ tinh khiết của hóa chất, nồng độ các chất ban đầu,
dụng cụ thí nghiệm có thể cũ qua nhiều năm sử dụng, hóa chất sử dụng được bảo quản lâu làm giảm
chất lượng, thao tác của người thí nghiệm có thể bị ảnh hưởng do độ nhạy giác quan,...
- Yếu tố quan trọng nhất là nồng độ chất ban đầu: vì khi điều chế nên sử dụng dư lượng anhydride
acetic để đảm bảo acid salycilic phản ứng hoàn toàn, tránh việc rửa quá nhiều lần làm hao hụt sảm
phẩm sau mỗi lần tinh chế. Từ đó tăng hiệu suất phản ứng.
6. Ứng dụng của aspirin?
- Thuộc nhóm thuốc chống viêm non-steroid. Còn có tác dụng giảm đau, hạ sốt. Ngoài ra, aspirin có tác
dụng chống kết tập tiểu cầu, khi dùng liều thấp kéo dài có thể phòng ngừa đau tim và hình thành cục
nghẽn trong mạch máu vì nó có thể làm giãn thành mạch máu tăng hiệu quả lưu thông máu. Đồng
thời, là thành phần chủ yếu trong các loại thuốc điều trị viêm khớp, thoái hóa và các loại bệnh liên
quan đến xương – sụn,... và nhiều ứng dụng ngoài y tế như: loại bỏ vết bẩn, làm sach phòng tắm, chữa
vách thạch cao, sạc điện xe hơi,...
B. PHẦN CHUNG CỦA NHÓM: 5 điểm
(Trong thí nghiệm)
Họ Tên: Nguyễn Huỳnh Vân Thanh MSSV:62000894
Lê Nguyễn Bảo Trang MSSV:62000927
Phan Huỳnh Bảo Trân MSSV:62000922
Nhóm: N1-04 Ngày Thực hành: 28/8/2022
Điểm Lời phê
1. Tiến hành thí nghiệm – mô tả hiện tượng và giải thích
Bước thực hiện Hiện tượng Giải thích
- Cho 5 (g) acid salycilic vào Khuấy đều dung dịch Hạn chế sự thất thoát của các chất
bằng cá từ, dung dịch cần thiết để tổng hợp aspirin trong
bình cầu. Sau đó, cho thêm
có màu trắng đục, dung dịch.
vào 10 (mL) anhydride rắn màu trắng (acid
salicylic) chưa tan
acetic vào bình cầu, tiếp tục
hết đọng dưới đáy
thêm từ từ H3PO4 vào dung bình cầu. Sau đó, tan
dần nhờ cá từ quay
dịch. Đun cách thủy ở 80 oC
liên tục, ống sinh hàn
trong 20 phút. được cấp nước từ
ống dẫn nước có tác
- Tiếp theo, cho khoảng 40
dụng làm lạnh các
giọt nước vào bình cầu đun
chất đang hóa hơi,
tiếp tục trong 10 phút.
khi đi ngang qua ống
sẽ ngưng tụ và quay
trở lại bình cầu
- Để nguội, làm lạnh hỗn hợp Sau khi hồi lưu xong, Do trong hỗn hợp không còn acid
dung dịch đưa vào salicylic dư nên khi cho FeCl3 vào
phản ứng bằng hỗn hợp
becher 250 mL ngâm tinh thể aspirin dung dịch có màu
sinh hàn (nước đá & muối). trong thau chứa hỗn của dung dịch FeCl3 và không có
hợp sinh hàn. Trong xuất hiện phức có màu tím. Vì vậy:
- Cho vào 3 (mL) methanol
becher dần xuất hiện Không cần tinh chế loại acid
vào tiếp tục đun cách thủy tinh thể màu trắng li salicylic.
ti. Sau một thời gian,
đến khi hỗn hợp tan hết. Để
hỗn hợp trong becher
nguội và làm lạnh. Cứ làm chuyển hoàn toàn
như vậy cho đến khi hỗn sang tinh thể màu
trắng hình kim.
hợp không còn hiện tượng
vẩn đục nữa. Đem đi kết
tinh.
- Lọc chân không thu được
aspirin.Lấy vài giọt FeCl3
vào ống nghiệm chứa một ít
tinh thể aspirin đã lọc được.
2. Kết quả và thảo luận
You might also like
- AspirinDocument9 pagesAspirinhieunvh123No ratings yet
- Báo Cáo Thí Nghiệm Hóa Hữu Cơ: Bài 4: Phản Ứng Sunfo Hóa - Tổng Hợp Acid SunfanilicDocument11 pagesBáo Cáo Thí Nghiệm Hóa Hữu Cơ: Bài 4: Phản Ứng Sunfo Hóa - Tổng Hợp Acid SunfanilicNguyễn Huỳnh Vân Thanh0% (1)
- Báo cáo Thí nghiệm Hóa phân tích - Bài 1, 2Document13 pagesBáo cáo Thí nghiệm Hóa phân tích - Bài 1, 262000949No ratings yet
- BAI 2 Báo Cáo Hóa H U CơDocument10 pagesBAI 2 Báo Cáo Hóa H U CơNguyễn Huỳnh Vân ThanhNo ratings yet
- Báo cáo Thí nghiệm Hóa phân tích - Bài 3, 4Document11 pagesBáo cáo Thí nghiệm Hóa phân tích - Bài 3, 462000949No ratings yet
- Bai 5 HÓA H UDocument7 pagesBai 5 HÓA H UNguyễn Huỳnh Vân ThanhNo ratings yet
- TNHHC B10 NhómTN08Document7 pagesTNHHC B10 NhómTN08Nguyễn PhướcNo ratings yet
- Bài 3 PH N NG Ester Hóa - T NG H P AspirinDocument6 pagesBài 3 PH N NG Ester Hóa - T NG H P Aspirinngovantien99No ratings yet
- Bài 9 PH N NG Oxi Hoá - T NG H P Acid BenzoicDocument7 pagesBài 9 PH N NG Oxi Hoá - T NG H P Acid Benzoicngovantien99No ratings yet
- Báo cáo Thí nghiệm Hóa phân tích - Bài 7, 8Document10 pagesBáo cáo Thí nghiệm Hóa phân tích - Bài 7, 862000949No ratings yet
- Hóa Dư CDocument11 pagesHóa Dư Chong luuNo ratings yet
- Bai 6 HÓA H UDocument6 pagesBai 6 HÓA H UNguyễn Huỳnh Vân ThanhNo ratings yet
- HĐBMDocument13 pagesHĐBMLinh PhamNo ratings yet
- Bài 3Document6 pagesBài 3Như 0605No ratings yet
- Nhom 1 To 2 Bai 4Document10 pagesNhom 1 To 2 Bai 4quynhquynh1324No ratings yet
- Bài 4 PH N NG Sunfo Hóa - T NG H P Acid SunfanilicDocument5 pagesBài 4 PH N NG Sunfo Hóa - T NG H P Acid Sunfanilicngovantien99No ratings yet
- BáocáoTNHHC 602036 T3 07 05Document59 pagesBáocáoTNHHC 602036 T3 07 05hieunvh123No ratings yet
- BCHHC - Bài 5 - Nhóm 3 T 5Document8 pagesBCHHC - Bài 5 - Nhóm 3 T 5Phan Mỹ ChâuNo ratings yet
- Do An NhapDocument2 pagesDo An NhapHồ NguyễnNo ratings yet
- BCHHC - Bài 3 - Nhóm - 3 T 05Document7 pagesBCHHC - Bài 3 - Nhóm - 3 T 05Phan Mỹ ChâuNo ratings yet
- T NG H P DEPDocument23 pagesT NG H P DEPHòa NguyễnNo ratings yet
- Tổng Hợp TCVL Các Chất Hữu CơDocument2 pagesTổng Hợp TCVL Các Chất Hữu CơThư NguyễnNo ratings yet
- Beige Nour Home and Lifestyle Contemporary Magazine 2Document24 pagesBeige Nour Home and Lifestyle Contemporary Magazine 2Ngọc LêNo ratings yet
- Nhẹ hơn h2o, không tan trong h2o Có mùi thơm Nhẹ hơn h20, không tan trong h2o, tan trong dung môi hữu cơ Có 4 amin tồn tại thể khí là Metyl Amin, Etyl Amin,Document16 pages Nhẹ hơn h2o, không tan trong h2o Có mùi thơm Nhẹ hơn h20, không tan trong h2o, tan trong dung môi hữu cơ Có 4 amin tồn tại thể khí là Metyl Amin, Etyl Amin,Nghĩa HoàngNo ratings yet
- CHƯƠNG 3 Phu Gia Thuc PhamDocument45 pagesCHƯƠNG 3 Phu Gia Thuc PhamTran Phong ThuNo ratings yet
- Báo Cáo Bài 9Document13 pagesBáo Cáo Bài 9phamtrucvy2003No ratings yet
- Bai6 NguyenThiDiemTrang 61900792 N0601Document6 pagesBai6 NguyenThiDiemTrang 61900792 N0601Diem TrangNo ratings yet
- PH19A1B - Nhóm 05 - Bài 1 - Phân Tích ĐơnDocument3 pagesPH19A1B - Nhóm 05 - Bài 1 - Phân Tích ĐơnPhạm QuỳnhNo ratings yet
- thuốc cốm IbuprofenDocument5 pagesthuốc cốm IbuprofenLinh NguyễnNo ratings yet
- Bán Butyl Cellosolve, BCS, Chống Mốc, Butyl Glycol, Dung Môi Pha SơnDocument1 pageBán Butyl Cellosolve, BCS, Chống Mốc, Butyl Glycol, Dung Môi Pha Sơn19 ShyangNo ratings yet
- CÂU HỎI THẢO LUẬN MÔN BCDocument12 pagesCÂU HỎI THẢO LUẬN MÔN BCPhạm QuỳnhNo ratings yet
- Đề cương Hỗn dịch, thuốc mỡ, thuốc đạnDocument25 pagesĐề cương Hỗn dịch, thuốc mỡ, thuốc đạnLuyieChan100% (14)
- ÔN TẬP MỸ PHẨMDocument9 pagesÔN TẬP MỸ PHẨMQuỳnh LưuNo ratings yet
- Báo-Cáo-Tn Hoa Huu CoDocument81 pagesBáo-Cáo-Tn Hoa Huu CoLinh NguyenNo ratings yet
- Quy Trình Thực Nghiệm Và Dụng Cụ Hóa Chất Để Tổng Hợp AspirinDocument7 pagesQuy Trình Thực Nghiệm Và Dụng Cụ Hóa Chất Để Tổng Hợp AspirinMinh MinhNo ratings yet
- HĐBM 1Document14 pagesHĐBM 1Linh PhamNo ratings yet
- Bai8 NguyenThiDiemTrang 61900792 N0601Document8 pagesBai8 NguyenThiDiemTrang 61900792 N0601Diem TrangNo ratings yet
- Bài 5 PH N NG Acetyl Hóa Amin Thơm - T NG H P AcetanilidDocument4 pagesBài 5 PH N NG Acetyl Hóa Amin Thơm - T NG H P Acetanilidngovantien99No ratings yet
- Vật Liệu Phi Kim LoạiDocument87 pagesVật Liệu Phi Kim LoạiLe Phu NguyenNo ratings yet
- TH C Hành Hóa Dư C 1 PDFDocument21 pagesTH C Hành Hóa Dư C 1 PDFasdasd asdasdNo ratings yet
- CHỦ ĐỀ 5 SEM 2Document12 pagesCHỦ ĐỀ 5 SEM 2Hah HuynNo ratings yet
- Dược Liệu: Định NghĩaDocument3 pagesDược Liệu: Định Nghĩa4- Nhật AnhNo ratings yet
- San Pham MPDocument24 pagesSan Pham MPPhuc Nguyen Pham XuanNo ratings yet
- Bài 2 ThinghiemHoavocoDocument4 pagesBài 2 ThinghiemHoavocoTrần Văn Duy ThịnhNo ratings yet
- Viên nén đặc biệtDocument76 pagesViên nén đặc biệtNguyễn Khánh HuyềnNo ratings yet
- Nhom Chat Trong MPDocument42 pagesNhom Chat Trong MPPhuc Nguyen Pham XuanNo ratings yet
- Xà PhòngDocument88 pagesXà PhòngTran KhanhNo ratings yet
- Báo Cáo Bài 2Document17 pagesBáo Cáo Bài 2phamtrucvy2003No ratings yet
- PhugiangaymaiDocument11 pagesPhugiangaymaiThảo DươngNo ratings yet
- Nhom7 lopU02ADocument8 pagesNhom7 lopU02ANgân NguyễnNo ratings yet
- C4 THÀNH PHẦN CHÍNH TRONG SP TẨY RỬADocument55 pagesC4 THÀNH PHẦN CHÍNH TRONG SP TẨY RỬAphamthanhloi2206No ratings yet
- Bào Chế Ôn TậpeditDocument36 pagesBào Chế Ôn TậpeditPham ThuyNo ratings yet
- ĐỀ CƯƠNG HÓA DƯỢC TTDocument7 pagesĐỀ CƯƠNG HÓA DƯỢC TTNgân StandardNo ratings yet
- BC SV Etylacetat N08Document7 pagesBC SV Etylacetat N08Nguyễn PhướcNo ratings yet
- Bai 8 HÓA H U CƠDocument8 pagesBai 8 HÓA H U CƠNguyễn Huỳnh Vân ThanhNo ratings yet
- PDF Nhiễm độc dung môi công nghiệpDocument71 pagesPDF Nhiễm độc dung môi công nghiệpMINH PHAN NGUYÊNNo ratings yet
- Bai 8 HÓA H U CƠDocument8 pagesBai 8 HÓA H U CƠNguyễn Huỳnh Vân ThanhNo ratings yet
- Bai 7 HÓA H UDocument9 pagesBai 7 HÓA H UNguyễn Huỳnh Vân ThanhNo ratings yet
- Bai 5 HÓA H UDocument7 pagesBai 5 HÓA H UNguyễn Huỳnh Vân ThanhNo ratings yet
- Bai 6 HÓA H UDocument6 pagesBai 6 HÓA H UNguyễn Huỳnh Vân ThanhNo ratings yet
- NG D NG C A TanninDocument3 pagesNG D NG C A TanninNguyễn Huỳnh Vân ThanhNo ratings yet
- Bơm Pittông Tác D NG ĐơnDocument2 pagesBơm Pittông Tác D NG ĐơnNguyễn Huỳnh Vân ThanhNo ratings yet
- Vật liệu họcDocument4 pagesVật liệu họcNguyễn Huỳnh Vân ThanhNo ratings yet